Μάθημα : Χημεία Α' Λυκείου - 2ο Κεφάλαιο - Χημικοί Δεσμοί
Κωδικός : 1251060328
1251060328 - ΜΙΧΑΗΛ ΣΜΑΡΑΓΔΑΚΗΣ
Περιγραφή Μαθήματος

Χημικός Δεσμός
Κανόνας Οκτάδας
Ατομική Ακτίνα
Ιοντικός Δεσμός
Ομοιοπολικός Δεσμός
Χημικός δεσμός είναι η δύναμη που συνδέει δυο άτομα ή ιόντα μεταξύ τους. Η δύναμη αυτή είναι ηλεκτρικής φύσης καθώς τα ηλεκτρόνια του ενός ατόμου έλκονται από τον πυρήνα του άλλου. Τα άτομα ενώνονται με δεσμούς καθώς προσπαθούν να φτάσουν σε μια σταθερότερη κατάσταση χαμηλότερης ενέργειας. Αυτό επιτυγχάνεται όταν το άτομο αποκτήσει ηλεκτρονιακή δομή ευγενούς αερίου. Το χαρακτηριστικό των ευγενών αερίων είναι ότι η εξωτερική τους στοιβάδα είναι πλήρης, δηλαδή περιέχει 8e (εκτός από την στοιβάδα Κ που χωράει μόνο 2).
Τα στοιχεία που έχουν 1,2 ή 3 ηλεκτρόνια στην εξωτερική στοιβάδα έχουν την τάση να τα διώξουν, με αυτό τον τρόπο η αρχική εξωτερική στοιβάδα παύει να υπάρχει και παραμένει η προηγούμενη στοιβάδα με 8 ηλεκτρόνια που είναι πλέον η εξωτερική.
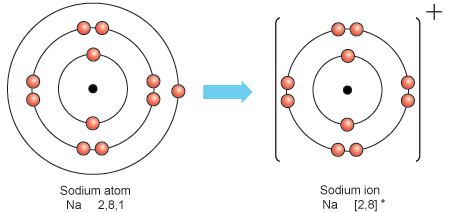
Τα στοιχεία που έχουν 5,6 ή 7 ηλεκτρόνια στην εξωτερική τους στοιβάδα έχουν την τάση να προσλάβουν επιπλέον ηλεκτρόνια ώστε να φτάσουν στα 8.
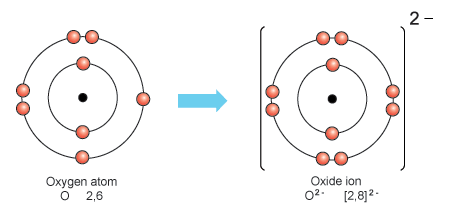
Ο ιοντικός δεσμός σχηματίζεται συνήθως ανάμεσα σε άτομα που θέλουν να αποβάλλουν ηλεκτρόνια και άτομα που θέλουν να προσλάβουν ηλεκτρόνια, δηλαδή ανάμεσα σε μέταλλα και αμέταλλα. Η παρουσία μετάλλου σε μια ουσία φανερώνει την ύπαρξη ιοντικού δεσμού. Καθώς το μέταλλο αποβάλλει ένα ή περισσότερα ηλεκτρόνια φορτίζεται θετικά ενώ το αμέταλλο αρνητικά. Τα κατιόντα και τα ανιόντα που δημιουργούνται από τη μεταφορά ηλεκτρονίων έλκονται με δυνάμεις Coulomb και συγκρατούνται μεταξύ τους.

Ιοντικές ενώσεις είναι κατά κύριο λόγο οξείδια μετάλλων (Να2Ο, MgO, Fe2O3), υδροξείδια μετάλλων (ΝαΟΗ, ΚΟΗ, Βα(ΟΗ)2) και άλατα. Εκτός από τα κατιόντα μετάλλων ένα σύνηθες κατιόν είναι το κατιόν του αμμωνίου (ΝΗ4+) που είναι πολυατομικό κατιόν. Πολυατομικά μπορεί να είναι και τα ανιόντα, τα οποία θα γνωρίσουμε παρακάτω (π.χ. θειϊκό SO42-)


Οι ιοντικές ουσίες είναι κρύσταλλοι οι οποίοι αποτελούνται από κατιόντα και ανιόντα στοιχισμένα με τέτοιο τρόπο ώστε τα θετικά να περιστοιχίζονται από αρνητικά και το αντίθετο. Δεν διακρίνονται μόρια.
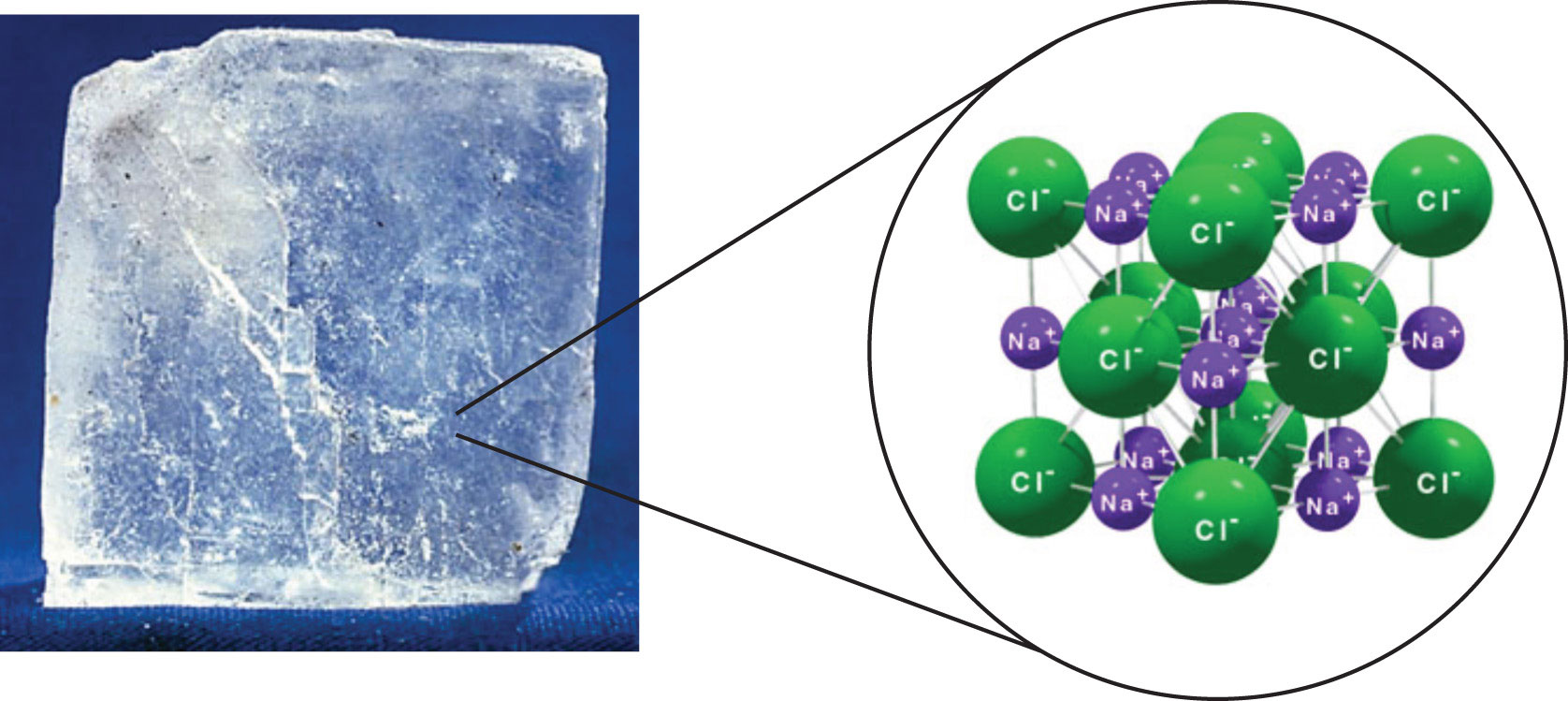
Οι δυνάμεις Coulomb που συγκρατούν τα ιόντα μεταξύ τους είναι αρκετά ισχυρές και τα συγκρατούν σταθερά στον κρύσταλλο, αυτό έχει σαν αποτέλεσμα οι περισσότερες ουσίες να είναι στερεά με υψηλά σημεία τήξεως, ενώ είναι σκληρά αλλά εύθραυστα υλικά. Σε στέρεη κατάσταση είναι κακοί αγωγοί του ηλεκτρισμού, όμως λιωμένα (τήγματα) άγουν τον ηλεκτρισμό. Οι ιοντικές ενώσεις είναι γενικά ευδιάλυτες στο νερό και τα υδατικά διαλύματά τους άγουν τον ηλεκτρισμό.
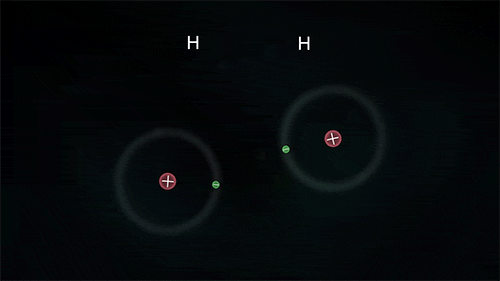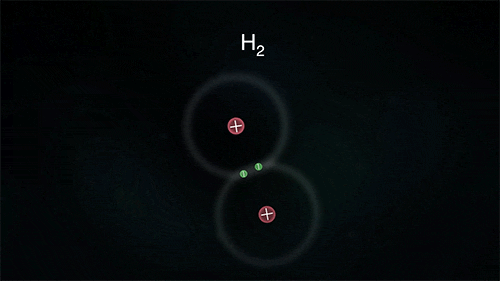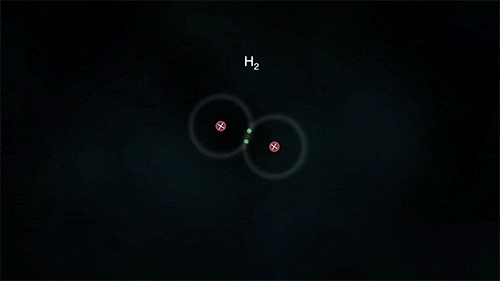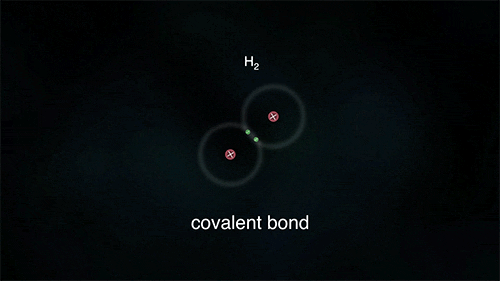
Ανάμεσα σε αμέταλλα, τα οποία θέλουν να αποκτήσουν ηλεκτρόνια, σχηματίζεται ένα διαφορετικό είδος δεσμού που ονομάζεται ομοιοπολικός. Τα άτομα μοιράζονται από κοινού κάποιο ή κάποια από τα ηλεκτρόνιά τους, τα "χρησιμοποιούν" δηλαδή και τα δυο.
Στον απλό ομοιοπολικό δεσμό, τα άτομα μοιράζονται ένα ζευγάρι ηλεκτρονίων (συνήθως ένα προέρχεται από το ένα άτομο και ένα από το άλλο) και ανήκουν και στα δυο. Μπορούν όμως να μοιράζονται δύο ζεύγη (διπλός δεσμός) ή και τρία ζεύγη ηλεκτρονίων (τριπλός δεσμός). Με αυτό τον τρόπο τα άτομα "κερδίζουν" επιπλέον ηλεκτρόνια αφού θεωρούν δικά τους και τα ηλεκτρόνια που μοιράζεται μαζί τους το άλλο άτομο, χωρίς όμως να μετατρέπονται σε ιόντα.

Όταν τα άτομα που συνδέονται είναι ίδια τότε τα ηλεκτρόνια ανήκουν εξίσου και στα δυο άτομα και ο δεσμός χαρακτηρίζεται ως Μη Πολικός Ομοιοπολικός. Όταν όμως τα άτομα που συνδέονται είναι διαφορετικά, το ένα έλκει τα κοινά ηλεκτρόνια πιο ισχυρά από το άλλο, οπότε βρίσκονται στον χώρο του περισσότερη ώρα. Ο δεσμός αυτός χαρακτηρίζεται ως Πολικός ομοιοπολικός καθώς το άτομο που έλκει ισχυρότερα τα ηλεκτρόνια εμφανίζεται να έχει μερικό αρνητικό φορτίο και το αδύναμο θετικό, οπότε παρατηρούνται θετικός και αρνητικός πόλος στον δεσμό. Ηλεκτραρνητικότητα ονομάζεται το μέτρο της ισχύος που έλκει ένα άτομο τα ηλεκτρόνια, όσο πιο ισχυρά τα έλκει τόσο πιο ηλεκτραρνητικό είναι.

Στην πραγματικότητα δεν υπάρχουν δεσμοί 100% ομοιοπολικοί και 100% ιοντικοί καθώς τα ηλεκτρόνια κινούνται παντού στο χώρο. Ο διαχωρισμός σε ομοιοπολικό και ιοντικό δεσμό υποδηλώνει που βρίσκονται τον περισσότερο χρόνο τα ηλεκτρόνια.

Ημερολόγιο
Ανακοινώσεις
Όλες...- - Δεν υπάρχουν ανακοινώσεις -