Μάθημα : Χημεία Προσανατολισμού - Κεφάλαιο 6 (Μέρος Δ')
Κωδικός : 1251060395
1251060395 - ΜΙΧΑΗΛ ΣΜΑΡΑΓΔΑΚΗΣ
Περιγραφή Μαθήματος
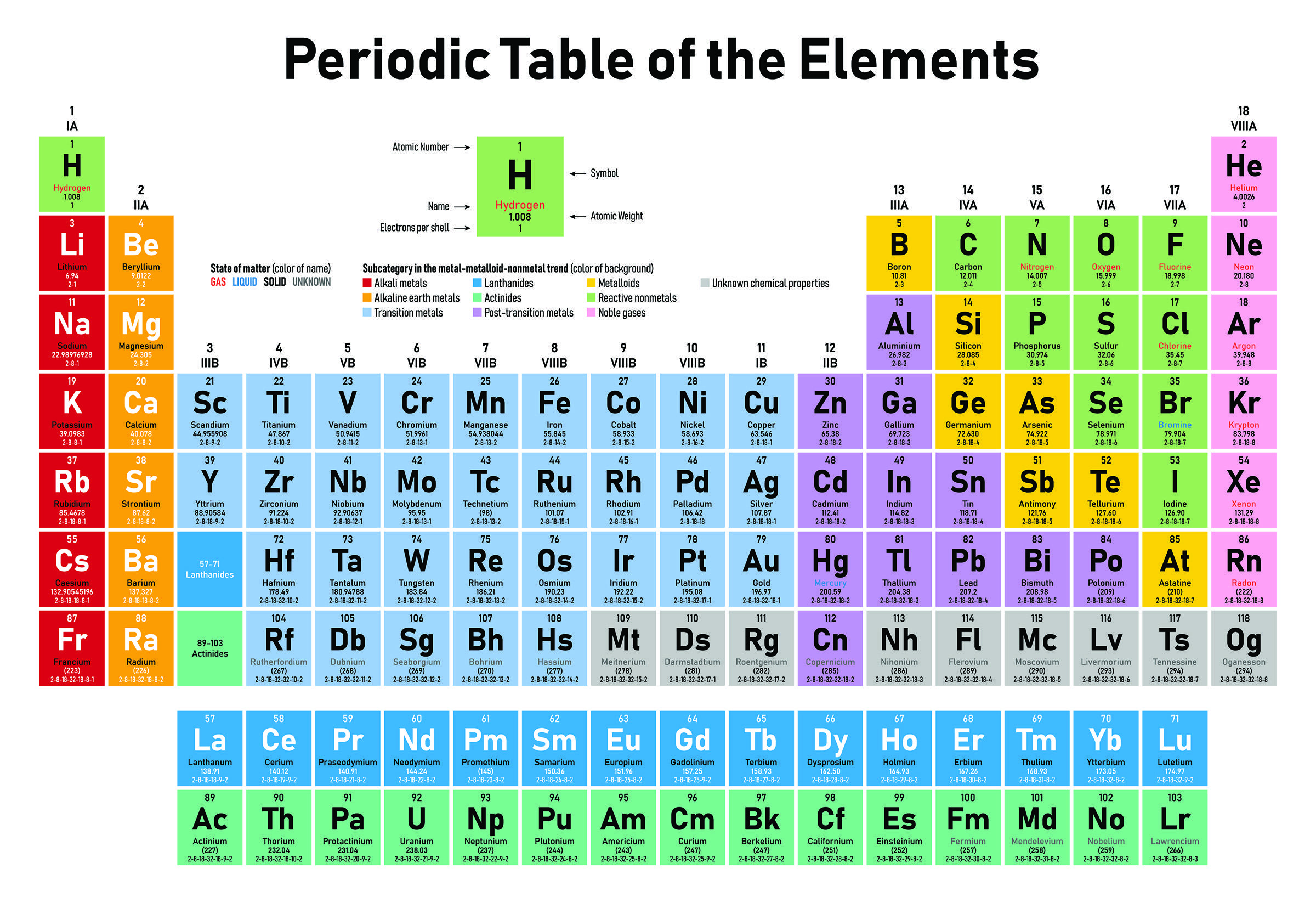
ΠΕΡΙΟΔΙΚΟΣ ΠΙΝΑΚΑΣ
Ο Περιοδικός Πίνακας είναι ένα σύστημα ταξινόμησης των χημικών στοιχείων κατά αυξανόμενο Ατομικό Αριθμό. Η δομή του πίνακα στηρίζεται στο Νόμο της Περιοδικότητας ο οποίος αναφέρει ότι:
"Η χημική συμπεριφορά των στοιχείων είναι περιοδική συνάρτηση του Ατομικού τους Αριθμού".
Τα στοιχεία κατανέμονται σε οριζόντιες γραμμές (περίοδοι) και κάθετες στήλες (ομάδες).
Στα στοιχεία που ανήκουν στην ίδια περίοδο ο αριθμός των στοιβάδων στις οποίες υπάρχουν ηλεκτρόνια είναι ίδιος.
Στα στοιχεία που ανήκουν στην ίδια ομάδα η εξωτερική στοιβάδα έχει τον ίδιο αριθμό ηλεκτρονίων με αποτέλεσμα να έχουν τις ίδιες χημικές ιδιότητες. Στις κύριες ομάδες (δύο πρώτες και έξι τελευταίες) ο αριθμός της ομάδας με το παλιό σύστημα αρίθμισης (ΙΑ-VIIIA) υποδεικνύει και τον αριθμό των ηλεκτρονίων σθένους.
Ο περιοδικός πίνακας χωρίζεται σε τομείς:
Ομάδες 1,2 (κύριες ομάδες) - Τομέας s. Το τελευταίο ηλεκτρόνιο έχει τοποθετηθεί σε τροχιακό s.
Ομάδες 3-12 (δευτερεύουσες ομάδες) - Τομέας d (στοιχεία μετάπτωσης). Το τελευταίο ηλεκτρόνιο έχει τοποθετηθεί σε τροχιακό d.
Oμάδες 13-18 (κύριες ομάδες) - Τομέας p.Το τελευταίο ηλεκτρόνιο έχει τοποθετηθεί σε τροχιακό p.
Κάτω από το κυρίως σώμα του Περιοδικού Πίνακα υπάρχει μια διπλή σειρά στοιχείων. Απετελούν τον τομέα f του περιοδικού πίνακα και είναι οι ομάδες των Λανθανίδων (πάνω) και των Ακτινίδων (κάτω). Το τελευταίο ηλεκτρόνιο σε αυτά τα στοιχεία έχει τοποθετηθεί σε τροχιακό f.
Οι σημαντικότερες ομάδες του Περιοδικού Πίνακα έχουν τα δικά τους χαρακτηριστικά ονόματα:
Τα στοιχεία της Ομάδας 1 (IA ή s1) ονομάζονται Αλκάλια. Είναι μέταλλα. Επισημαίνεται ότι το Υδρογόνο που συχνά τοποθετείται στην 1η Ομάδα, δεν είναι Αλκάλιο και έχει εντελώς διαφορετική χημική συμπεριφορά, ενώ ανήκει στα αμέταλλα.
Τα στοιχεία της Ομάδας 2 (ΙIA ή s2) ονομάζονται Αλκαλικές Γαίες και είναι και αυτά μέταλλα.
Τα στοιχεία της Ομάδας 17 (VIIA ή p5) oνομάζονται Αλογόνα και είναι αμέταλλα.
Τα στοιχεία της Ομάδας 18 (VIIIA ή p6) oνομάζονται Ευγενή Αέρια, είναι αμέταλλα και χαρακτηριστικό τους είναι η χημική αδράνεια καθώς έχουν συμπληρωμένη την εξωτερική τους στοιβάδα (σύμφωνα με τον κανόνα της οκτάδας). Εκτός από το He που έχει μια στοιβάδα η οποία γεμίζει με 2e, όλα τα άλλα Ευγενή Αέρια έχουν δομή ηλεκτρονίων σθένους n2p6, δηλαδή έχουν 8e στην αξωτερική στοιβάδα.
Υπενθυμίζεται ότι η σειρά κατά την οποία πληρώνονται οι υποστοιβάδες με ηλεκτρόνια είναι η παρακάτω:
1s2 (Περίοδος 1)
2s2 2p6 (Περίοδος 2)
3s2 3p6 (Περίοδος 3)
4s2 3d10 4p6 (Περίοδος 4)
5s2 4d10 5p6 (Περίοδος 5)
6s2 5d10 4f14 6p6 (Περίοδος 6)
7s2 6d10 5f14 7p6 (Περίοδος 7)
Αναλυτικότερα:
1η Περίοδος - Συμπληρώνεται η στοιβάδα K (n=1), η οποία αποτελείται από ένα τροχιακό το 1s και κατά συνέπεια χωράει ως 2e. Έτσι βρίσκουμε μόνο 2 στοιχεία το Υδρογόνο H (1s1) και το Ήλιον He (1s2).

2η Περίοδος - Συμπληρώνεται η στοιβάδα L (n=2), η οποία αποτελείται από 1 τροχιακό s και 3 τροχιακά p, κατά συνέπεια χωράει εως 8e. Πράγματι αποτελείται από 8 στοιχεία, 2 στον τομέα s και 6 στον τομέα p.

3η Περίοδος - Περιέχει 8 στοιχεία αντίστοιχα με την 2η καθώς μετά τα τροχιακά 3s και 3p συμπληρώνεται το 4s και όχι τα 3d.

4η Περίοδος - Περιέχει 18 στοιχεία καθώς μετά τα 4s και πριν τα 4p τροχιακά συμπληρώνονται τα πέντε 3d τροχιακά. Στην 4η περίοδο έχουμε την πρώτη σειρά στοιχείων μετάπτωσης τα οποία φυσικά είναι 10.

5η Περίοδος - Αντίστοιχη μορφή με την 4η Περίοδο, συμπληρώνονται κατά σειρά τα 5s - 4d - 5p άρα 18 στοιχεία κι εδώ σε 3 τομείς.

6η Περίοδος - Ενώ έχει αντίστοιχη μορφή με τις 2 προηγούμενες, μετά το 3ο στοιχείο (Λανθάνιο La) η σειρά συνεχίζεται με την 1η σειρά των στοιχείων f (τροχιακά 4f) τα οποία είναι 14 καθώς τα f τροχιακά είναι 7. Μετά τα 4f τροχιακά, συμπληρώνονται τα 5d και τέλος τα 6p.

7η Περίοδος - Oμοίως με την 6η, εδώ έχουμε μετά το Ακτίνιο Ac να ακολουθεί η 2η σειρά του τομέα f (Ακτινίδες).

Ημερολόγιο
Ανακοινώσεις
Όλες...- - Δεν υπάρχουν ανακοινώσεις -