Μάθημα : Χημεία Προσανατολισμού - Κεφάλαιο 1 - Παρ.1.1 (Α' μέρος)
Κωδικός : EL657141
EL657141 - ΜΙΧΑΗΛ ΣΜΑΡΑΓΔΑΚΗΣ
Περιγραφή Μαθήματος

Υπενθύμιση: Ενδομοριακές Δυνάμεις
Πολικότητα Δεσμού
Διπολική ροπή
Ξεκινώντας, ας κάνουμε μια σύνοψη στις χαρακτηριστικές μορφές με τις οποίες συναντάμε τα άτομα στη φύση και στην κατηγοριοποίηση τους σε πολικές και άπολες. Ο λόγος που τα άτομα απαντώνται στις μορφές αυτές είναι η επιθυμία τους να ελαχιστοποιήσουν την ενέργειά τους αποκτώντας ηλεκτρονιακή δομή ευγενούς αερίου. Η επίτευξη της κατάστασης αυτής, είτε από ένα μοναχικό άτομο είτε από μια ομάδα ατόμων, τους προσδίδει μια σχετική ανεξαρτησία. Θα μπορούσαμε να πούμε ότι οι διαμοριακές δυνάμεις (με τις οποίες ασχολείται το παρόν κεφάλαιο) ασκούνται μεταξύ των ανεξάρτητων αυτών οντοτήτων.
Α. Φορτισμένες χημικές οντότητες.
- Μονοατομικά ιόντα (Na+, K+, Ca2+, Fe3+, F-, S2-, P3- κ.α.).
- Πολυατομικά ιόντα (ΝΗ4+, ΝΟ3-, CN-, SO32-, PO43- κ.α.).
Τα παραπάνω τα συναντάμε είτε σε κρύσταλλους ιοντικών ενώσεων ή διαλυμένα σε κάποιο διάλυμα (συνήθως υδατικό δηλ. διαλύτης είναι το νερό).
Β. Ουδέτερες χημικές οντότητες.
- Απομονωμένα άτομα (τα ευγενή αέρια He, Ne, Ar, Kr, Xe, Rn). Πάντα άπολα.
- Mόρια (ουδέτερες ομάδες ατόμων). Πολικά ή άπολα. Για τις ανάγκες του μαθήματος θα θεωρούμε άπολα όλα τα χημικά στοιχεία (O2, N2, F2) και τους υδρογονάνθρακες (CxHy), ενώ τις χημικές ενώσεις που περιέχουν ηλεκτραρνητικά άτομα πολικές. (Οι εξαιρέσεις στον απλοϊκό αυτό κανόνα απαιτούν την γνώση της τρισδιάστατης δομής του μορίου για τη μελέτη της διπολικής ροπής του. Έτσι για παράδειγμα το Ο3 είναι πολικό στοιχείο, ενώ τα CO2, CCl4 άπολα).
Πριν πάμε στις διαμοριακές δυνάμεις ας θυμηθούμε τις ενδομοριακές και τον διαχωρισμό των ενώσεων σε ΙΟΝΤΙΚΕΣ και ΟΜΟΙΟΠΟΛΙΚΕΣ, όπως τον γνωρίσαμε στην Α' Λυκείου.
Τα μέταλλα είναι άτομα το οποία επιδιώκουν να διώξουν ένα ή περισσότερα ηλεκτρόνια από το άτομο τους (οπότε μετατρέπονται σε κατιόντα) ώστε να επιτύχουν μεγαλύτερη σταθερότητα. Όταν υπάρχουν διαθέσιμα αμέταλλα προσλαμβάνουν τα ηλεκτρόνια αυτά (οπότε μετατρέπονται σε ανιόντα). Με αυτό τον τρόπο σχηματίζονται οι Ιοντικές ενώσεις.
Στις ιοντικές ενώσεις τα ΚΑΤΙΟΝΤΑ και ΑΝΤΙΟΝΤΑ από τα οποία αποτελούνται συγκρατούνται στον κρύσταλλο των ενώσεων με Ιοντικούς Δεσμούς (δυνάμεις Coulomb). Οι ιοντικοί δεσμοί είναι ισχυροί, με αποτέλεσμα τα ιόντα τα συγκρατούνται σταθερά μεταξύ τους και οι ιοντικές ενώσεις να είναι στη συντριπτική πλειοψηφία σε στερεή κατάσταση σε θερμοκρασία περιβάλλοντος.
 Η χημική ένωση Χλωριούχο Νάτριο NaCl, αποτελείται από ιόντα Na+ και Cl-, τα οποία συναντάμε στον κρύσταλλο με αναλογία 1:1 όπως άλλωστε περιγράφεται από το Μοριακό Τύπο της. Όπως και σε όλες τις άλλες ιοντικές ενώσεις, δεν διακρίνονται μόρια, καθώς τα ιόντα έχοντας πλέον αποκτήσει δομή ευγενούς αερίου δρουν ως ανεξάρτητες μεταξύ τους οντότητες. Ο λόγος που συγκρατούνται μεταξύ τους είναι οι ελκτικές δυνάμεις Coulomb μεταξύ θετικών και αρνητικών ιόντων.
Η χημική ένωση Χλωριούχο Νάτριο NaCl, αποτελείται από ιόντα Na+ και Cl-, τα οποία συναντάμε στον κρύσταλλο με αναλογία 1:1 όπως άλλωστε περιγράφεται από το Μοριακό Τύπο της. Όπως και σε όλες τις άλλες ιοντικές ενώσεις, δεν διακρίνονται μόρια, καθώς τα ιόντα έχοντας πλέον αποκτήσει δομή ευγενούς αερίου δρουν ως ανεξάρτητες μεταξύ τους οντότητες. Ο λόγος που συγκρατούνται μεταξύ τους είναι οι ελκτικές δυνάμεις Coulomb μεταξύ θετικών και αρνητικών ιόντων.
 Ένα "μόριο" Ανθρακικού Νατρίου (Na2CO3). Παρατηρούμε ότι αποτελείται από 3 ιόντα (2 κατιόντα Νατρίου και ένα Ανθρακικό) τα οποία είναι μεταξύ τους ανεξάρτητα. Το ανιόν στην περίπτωση αυτή είναι πολυατομικό (αποτελείται από 1 άτομο C και 3 άτομα O) και καθώς αποτελείται από τα αμέταλλα Άνθρακα και Οξυγόνο, τα άτομα του συνδέονται με ομοιοπολικούς δεσμούς και κατά συνέπεια είναι δεσμευμένα μεταξύ τους και όχι ανεξάρτητα. Ενώ σαν ομάδα έχουν επιτύχει όλα τη δομή ευγενούς αερίου - με την προσθήκη και των ηλεκτρονίων των Νατρίων, οπότε η ομάδα είναι αυτόνομη, τα άτομα που την αποτελούν αν απομακρυνθούν το ένα από το άλλο θα παύσουν να έχουν την ιδανική αυτή δομή, οπότε και δεν θα το κάνουν.
Ένα "μόριο" Ανθρακικού Νατρίου (Na2CO3). Παρατηρούμε ότι αποτελείται από 3 ιόντα (2 κατιόντα Νατρίου και ένα Ανθρακικό) τα οποία είναι μεταξύ τους ανεξάρτητα. Το ανιόν στην περίπτωση αυτή είναι πολυατομικό (αποτελείται από 1 άτομο C και 3 άτομα O) και καθώς αποτελείται από τα αμέταλλα Άνθρακα και Οξυγόνο, τα άτομα του συνδέονται με ομοιοπολικούς δεσμούς και κατά συνέπεια είναι δεσμευμένα μεταξύ τους και όχι ανεξάρτητα. Ενώ σαν ομάδα έχουν επιτύχει όλα τη δομή ευγενούς αερίου - με την προσθήκη και των ηλεκτρονίων των Νατρίων, οπότε η ομάδα είναι αυτόνομη, τα άτομα που την αποτελούν αν απομακρυνθούν το ένα από το άλλο θα παύσουν να έχουν την ιδανική αυτή δομή, οπότε και δεν θα το κάνουν.
Παρατήρηση: Αν και δεν υπάρχουν μόρια στις ιοντικές ενώσεις, ωστόσο ο όρος χρησιμοποιείται κάποιες φορές κατ' αντιστοιχία με τις ομοιοπολικές ενώσεις. Επίσης χρησιμοποιείται και ο όρος Μοριακό Βάρος (Mr) χάρην απλότητας καθώς επιτελεί τον σκοπό του ακόμη κι αν σαν όρος δεν είναι σωστός στην περίπτωση αυτή.
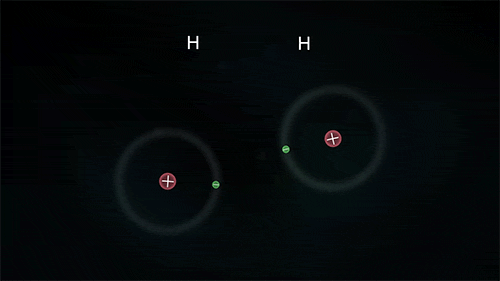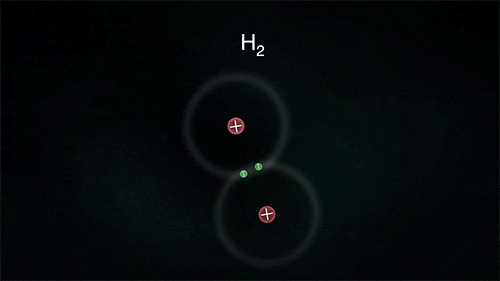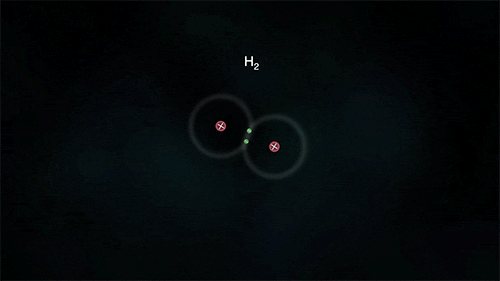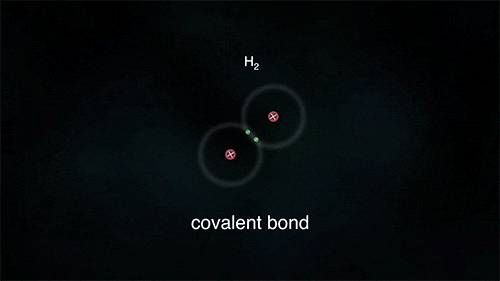
Τα άτομα των αμετάλλων συνδέονται μεταξύ τους με διαφορετικό τρόπο, καθώς θέλουν να αποκτήσουν επιπλέον ηλεκτρόνια και δεν είναι διατεθιμένα να δώσουν το ένα στο άλλο. Έτσι σχηματίζεται ένας διαφορετικός τύπος δεσμού καθώς τα άτομα μοιράζονται ένα ή περισσότερα ζευγάρια ηλεκτρονίων. Τα ηλεκτρόνια αυτά ανήκουν και στα δυο άτομα και είναι ο λόγος για τον οποίο τα άτομα συγκρατούνται μεταξύ τους σχηματίζονται ενώσεις. Ο πυρήνας του κάθε ατόμου έλκει εκτός από τα ηλεκτρόνια του και ηλεκτρόνια του γειτονικού (ή των γειτονικών ατόμων) συγκρατώντας τα άτομα με ομοιοπολικό δεσμό.
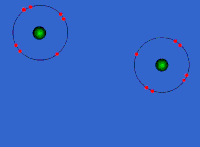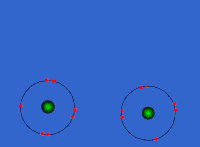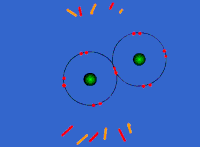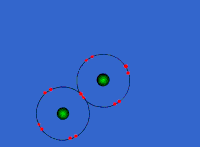
Στις ομοιοπολικές ενώσεις τα ΑΤΟΜΑ συνδέονται μεταξύ τους σχηματίζοντας ΜΟΡΙΑ με ομοιοπολικούς δεσμούς οι οποίοι οφείλονται στην έλξη ηλεκτρονίων ενός ατόμου από τους πυρήνες των ατόμων που συνδέονται με αυτό (ή τον πυρήνα του ατόμου που συνδέεται με αυτό αν είναι μόνο ένα). Τα μόρια είναι διακριτές ομάδες ατόμων όπως αυτές περιγράφονται από τον μοριακό τύπο της ένωσης.
Eνώ οι ομοιπολικοί δεσμοί είναι αρκετά ισχυροί (σε ορισμένες περιπτώσεις αντίστοιχης ισχύος με τους ιοντικούς) με αποτέλεσμα οι ομοιοπολικές ενώσεις να είναι σταθερές στη φύση και να μη διασπώνται εύκολα, ωστόσο ο ρόλος τους περιορίζεται στη σύνδεση μεταξύ των ατόμων του ίδιου μορίου και όχι μεταξύ ατόμων διαφορετικών μορίων. Το κάθε μόριο είναι ανεξάρτητο από τα γειτονικά του και καθώς δεν είναι φορτισμένα όπως τα ιόντα οι αλληλεπιδράσεις μεταξύ τους είναι περιορισμένες. Έτσι οι ομοιοπολικές ουσίες παρουσιάζουν εντελώς διαφορετικές ιδιότητες από τις ιοντικές.
Δεδομένου ότι ιοντικές και ομοιοπολικές ενώσεις παρουσιάζουν σημαντικές διαφορές λόγω της φύσης τους, είναι απαραίτητο να μπορούμε να τις διακρίνουμε μεταξύ τους. Οι ιοντικές ενώσεις αναγνωρίζονται από την παρουσία κάποιου μετάλλου (το οποία υπάρχει σαν κατιόν) ή του κατιόντος του αμμωνίου.
Συνοπτικά:
- Ιοντικές ενώσεις: Στους κρυστάλλους των ενώσεων αυτών τα ιόντα συγκρατούνται μέσω δυνάμεων Coulomb μεταξύ κατιόντων (κυρίως μετάλλων Κ+, Να+, Li+, Μg2+, Ca2+, Ba2+, Cu+ κ.α.) , και ανιόντων (μονοατομικών F-, Cl-, Br-, I-, Ο2- ή πολυατομικών ΝΟ3-, ClO4-, CN-, SO42-, CO32-, PO43-, MnO4-, Cr2O72-). Εκτός από τα μονοατομικά κατιόντα των μετάλλων, σημαντικό κατιόν είναι και το πολυατομικό ΝΗ4+, και τα αντίστοιχα με αυτό οργανικά αμινικά ιόντα τα οποία διαφέρουν από το αμμώνιο καθώς ένα έως τρία Η έχουν αντικατασταθεί με ανθρακικές αλυσίδες, π.χ. CH3NH3+, (CH3CH2)2NH2+ κλπ. Τις ιοντικές ενώσεις τις αναγνωρίζουμε από την ύπαρξη κάποιου μετάλλου ή αμμωνίου στην ένωση. Στις ιοντικές ενώσεις δεν διακρίνουμε μόρια!
- Ομοιοπολικές ενώσεις: Στα μόρια των ενώσεων αυτών τα άτομα μοιράζονται ένα, δύο ή τρία ζευγάρια ηλεκτρονίων (απλός, διπλός ή τριπλός δεσμός) και συγκρατούνται από τις έλξεις μεταξύ των πυρήνων τους και των κοινών ηλεκτρονίων. Oι ομοιοπολικοί δεσμοί μπορεί να απεικονίζονται με απλές διπλές ή τριπλές γραμμές (συντακτικός τύπος), π.χ. Η-CΞN, O=C=O. Αν μια ένωση δεν είναι ιοντική (σύμφωνα με τα προαναφερθέντα) τότε είναι ομοιοπολική.
Στους Ιοντικούς Δεσμούς υπάρχουν διακριτά θετικά και αρνητικά ιόντα. Στους ομοιοπολικούς δεσμούς, όπως έχει αναφερθεί και στην Α' Λυκείου, μπορεί να παρατηρηθεί πόλωση (ύπαρξη θετικού και αρνητικού πόλου) και κατά συνέπεια παρουσία μερικών φορτίων. Έτσι οι ομοιοπολικοί δεσμοί διακρίνονται σε ΠΟΛΙΚΟΥΣ και ΜΗ ΠΟΛΙΚΟΥΣ, ανάλογα με το αν παρατηρείται ή όχι ανισοκατανομή του φορτίου στα μόριά τους.

Μη πολικοί ομοιοπολικοί: όταν ίδια άτομα μοιράζονται ηλεκτρόνια, τα έλκουν με την ίδια δύναμη και τα ηλεκτρόνια μοιράζονται εξίσου στα άτομα.

Πολικοί ομοιοπολικοί δεσμοί: όταν διαφορετικά άτομα μοιράζονται ηλεκτρόνια, τα ηλεκτρόνια βρίσκονται τον περισσότερο χρόνο στην πλευρά του πιο ηλεκτραρνητικού ατόμου το οποίο τα έλκει ισχυρότερα. Αυτό έχει σαν αποτέλεσμα στις δυο πλευρές του δεσμού να εμφανίζονται μερικά φορτία (όχι πλήρη) και ο δεσμός να είναι πολωμένος (να έχει θετικό και αρνητικό πόλο).

Υπενθύμιση: Ηλεκτραρνητικότητα
Το μέτρο της ισχύος με την οποία έλκει ένα άτομο ηλεκτρόνια στην περιοχή του. Τα σημαντικότερα στοιχεία κατά σειρά ηλεκτραρνητικότητας από το ισχυρότερο στο ασθενέστερο: F > O > N > Cl > Br > I > .... > C > H
H ηλεκτραρνητικότητα αυξάνεται όσο προχωράμε προς τα πάνω και προς τα δεξιά στον Περιοδικό Πίνακα.
Παρατήρηση: Στην πραγματικότητα οι χημικοί δεσμοί δεν είναι 100% ιοντικοί ή 100% ομοιοπολικοί αλλά κάτι ανάμεσα στα δυο. Η ύπαρξη πολικότητας π.χ. στον ομοιοπολικό δεσμό υποδηλώνει ιοντικό χαρακτήρα δεσμό. Και αντίθετα υπάρχουν ενώσεις που ενώ θα περιμέναμε να είναι ιοντικές, ο χαρακτήρας του δεσμού τους είναι ομοιοπολικός (π.χ. BeF2).
Η διπολική ροπή (μ) είναι διανυσματικό μέγεθος και αποτελεί το μέτρο της πολικότητας ενός δεσμού ή ενός μορίου.
Η κατεύθυνση του διανύσματος είναι από το λιγότερο ηλεκτραρνητικό άτομο (θετικό πόλο) προς το πιο ηλεκτραρνητικό (αρνητικό πόλο).
Η διπολική ροπή ενός μορίου είναι το διανυσματικό άθροισμα των διπολικών ροπών των δεσμών του.
Αυτό έχει σαν αποτέλεσμα ένα συμμετρικό μόριο το οποίο έχει πολωμένους δεσμούς να μην έχει διπολική ροπή καθώς οι επιμέρους διπολικές ροπές των δεσμών του αλληλοαναιρούνται. Στα διατομικά μόρια η διπολική ροπή του δεσμού είναι προφανώς και η διπολική ροπή του μορίου.
Παραδείγματα:

Στο μόριο του νερού υπάρχει τόσο διπολική ροπή στους δεσμούς του (με κατεύθυνση προς το πιο ηλεκτραρνητικό O) όσο και συνολική διπολική ροπή στο μόριο. Παρατηρούμε ότι το μόριο δεν είναι πλήρως συμμετρικό, οπότε αναμένεται η συνολική διπολική ροπή να μην είναι μηδενική.
Αντίθετα στο μόριο του διοξειδίου του άνθρακα, υπάρχουν μεν διπολικές ροπές στους δεσμούς (πάλι με κατεύθυνση το πιο ηλεκτραρνητικό Ο) αλλά αλληλεξουδετερώνονται με αποτέλεσμα το μόριο να μην παρουσιάζει διπολική ροπή, λόγω της συμμετρίας του.
Άλλα παραδείγματα:

Με τα ροζ βελάκια φαίνονται οι διπολικές ροπές στους δεσμούς και με το γαλάζιο η συνολική ροπή αν υπάρχει.
1. Να βρείτε τις διπολικές ροπές των δεσμών και τις συνολικές ροπές στα παρακάτω μόριο, όπου υπάρχουν.
SO2 ![]()
ΗCN ![]()
I2
HCl 
BF3 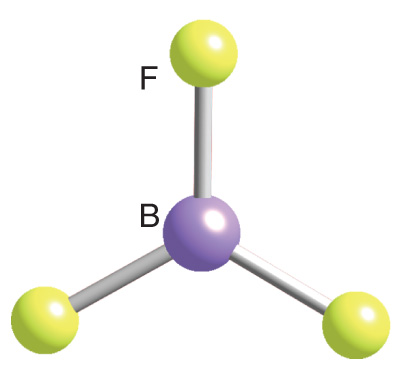
2. Στο μόριο του HF η διπολική ροπή είναι 1,82D και το μήκος του δεσμού Η-F είναι 0,92Å. Να υπολογιστεί το σχετικό φορτίο +δ/-δ που εμφανίζεται στα άτομα του Η και του F αντίστοιχα.
Δίνονται: 1Å = 10-10m, 1D =3,34 . 10-30 C.m και το φορτίο του e=1,6.10-19 C.
Ημερολόγιο
Ανακοινώσεις
Όλες...- - Δεν υπάρχουν ανακοινώσεις -