Μάθημα : Χημεία Προσανατολισμού - Κεφάλαιο 1 - Παρ.1.1 (Γ' μέρος)
Κωδικός : EL657155
EL657155 - ΜΙΧΑΗΛ ΣΜΑΡΑΓΔΑΚΗΣ
Περιγραφή Μαθήματος

Δυνάμεις Διπόλου - Διπόλου
Δυνάμεις Υδρογόνου
Μεγαλύτερες σε ισχύ από τις δυνάμεις London, οι δυνάμεις διπόλου – διπόλου εμφανίζονται σε ουσίες των οποίων τα μόρια εμφανίζουν διπολική ροπή και επομένως είναι μόνιμα δίπολα. Τα μόρια στις ουσίες αυτές διευθετούνται με τέτοιο τρόπο στο χώρο ώστε ο θετικός πόλος του ενός να βρίσκεται κοντά σε αρνητικούς πόλους των γειτονικών μορίων και το αντίθετο, μεγιστοποιώντας έτσι τις ελκτικές δυνάμεις και ελαχιστοποιώντας τις απωστικές (μεταξύ ομόνυμων πόλων).

Όσο μεγαλύτερη η διπολική ροπή των μορίων, τόσο μεγαλύτερα τα μερικά φορτία δ+ και δ- στους πόλους και ισχυρότερες οι απωστικές δυνάμεις. Η διπολική ροπή ενός μορίου εξαρτάται από το σχήμα του μορίου όπως είδαμε στις σχετικές ασκήσεις. Εφόσον δεν είναι μηδενική λόγω συμμετρίας, εξαρτάται από τη διαφορά ηλεκτραρνητικότητας μεταξύ των ατόμων (εφόσον αυτό επηρεάζει τη διπολική ροπή του δεσμού). Μεγαλύτερες διαφορές ηλεκτραρνητικότητας μεταξύ διπλανών ατόμων συνεπάγεται μεγαλύτερη διπολική ροπή.
ΠΡΟΣΟΧΗ! Καθώς το Mr παίζει σημαντικό ρόλο στον καθορισμό του Σ.Β. (μεγαλύτερο Mr ⟶ μεγαλύτερο Σ.Β.) συγκρίνουμε πάντα ενώσεις με παρεμφερή Mr.
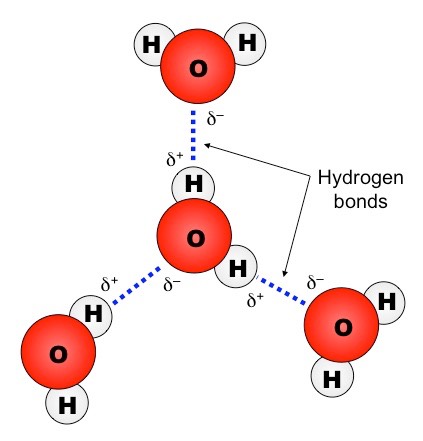
Όταν ενώνεται με ομοιοπολικό δεσμό το Η (πολύ χαμηλή ηλεκτραρνητικότητα) με ένα εκ των F, O, N (τα τρια πιο ηλεκτραρνητικά) η πόλωση του δεσμού είναι πολύ μεγάλη. Αυτό έχει σαν συνέπεια οι διαμοριακές δυνάμεις μεταξύ μορίων που περιέχουν τέτοιους δεσμούς να είναι σημαντικά ισχυρότερες από τις υπόλοιπες περιπτώσεις διπόλου – διπόλου.
Για το λόγο αυτό ξεχωρίζουμε αυτές τις δυνάμεις και τις ονομάζουμε Δεσμούς Υδρογόνου και Γέφυρες Υδρογόνου. Οι δεσμοί αυτοί σχηματίζονται αποκλειστικά μεταξύ ενός Η (ενωμένου με F, O ή Ν) και ενός F, O, ή N ενός άλλου μορίου (το οποίο είναι ενωμένο με Η ή και C).

Εκτός από τις παραπάνω περιπτώσεις, αξιοσημείωτη είναι και η περίπτωση δεσμών διπόλου – ιόντος που αναπτύσσονται μεταξύ ιόντων διαλυμένων μέσα σε κάποιο πολικό διαλύτη. Π.χ. τα ιόντα Na+ και Cl- με τα μόρια του νερού (H2O) σε ένα διάλυμα αλατόνερου. Οι δυνάμεις αυτές εξηγούν την ικανότητα διάλυσης των διαφόρων ουσιών στο νερό και άλλους διαλύτες. Σε αρκετές περιπτώσεις η ισχύς τους είναι εφάμιλλη της ισχύος των δυνάμεων στον ιοντικό και ομοιοπολικό δεσμό και είναι μεγαλύτερης ισχύος από τις δυνάμεις διπόλου – διπόλου.
Γενικά ισχύει ο κανόνας «τα όμοια διαλύουν όμοια», δηλαδή πολικές/ιοντικές ενώσεις διαλύονται σε πολικούς διαλύτες και άπολες ενώσεις σε άπολους διαλύτες.
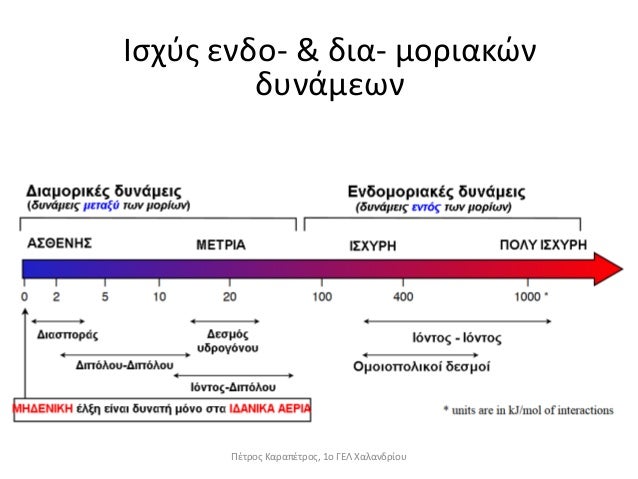
Συνοψίζοντας, υπενθυμίζεται ότι οι δεσμοί κατά σειρά αυξανόμενης ισχύος έχουν ως εξής:
London < Δίπολο–Δίπολο < Δεσμοί Υδρογόνου < Δίπολο–Ιον < Ιόν – Ιόν (ιοντικός δεσμός)
και ότι ισχυρότεροι δεσμοί συνεπάγονται μεγαλύτερο σημείο βρασμού.
Όπως προαναφέρθηκε εκτός από την ισχύ των δεσμών σημαντικό ρόλο παίζει και το Μοριακό Βάρος της ουσίας, με μεγαλύτερο Μ.Β. να συνεπάγεται μεγαλύτερο Σημείο Βρασμού. Βέβαια όσο μεγαλύτερη είναι η ισχύς των δεσμών τόσο μικρότερη είναι η επίδραση του Μ.Β. με αποτέλεσμα να είναι καθοριστικό στις άπολες ενώσεις.
Χαρακτηριστικό παράδειγμα είναι η σύγκριση των υδραλογόνων HF, HCl, HBr και ΗΙ. Ενώ τα τρια τελευταία είναι περιπτώσεις δυνάμεων διπόλου-διπόλου και το Μοριακό Βάρος είναι αυτό που καθορίζει τη διαφορά στο Σημείο Βρασμού, στο HF λόγω του πολωμένου δεσμού H-F σχηματίζονται δεσμοί Υδρογόνου μεταξύ των μορίων του και είναι αυτοί που καθορίζουν το Σημείο Βρασμού του.
Σε κάθε περίπτωση όταν μας ζητείται να συγκρίνουμε δυο ουσίες ως προς το Σημείο Βρασμού τους, θα πρέπει να αναφερόμαστε και στο είδος των δυνάμεων και στο Μοριακό Βάρος.

Όπως βλέπουμε και από τον παραπάνω πίνακα, η διαφορές στις ενέργειες των διαμοριακών δυνάμεων είναι σημαντικές ώστε να υπερτερούν των άλλων παραγόντων.
Συνοψίζοντας, για την σύγκριση του Σημείου Βρασμού ελέγχουμε κατά σειρά:
1. Είδος διαμοριακών δυνάμεων. Αν είναι ίδιες τότε ελέγχουμε
2. Μοριακό Βάρος. Αν έχουμε άπολες ενώσεις ίδιου ή παρεμφερούς Μοριακού Βάρους τότε ελέγχουμε
3. Σχήμα μορίου.
- Ένα υγρό Α όταν αναμιγνείεται με το νερό, δεν διαλύεται καθόλου αλλά σχηματίζει ξεχωριστή φάση. Η ουσία B διαλύεται πολύ καλά στο υγρό Α. Ποια από τις παρακάτω θα μπορούσε να είναι η ουσία Β;
α) ΝΗ4Cl β) ΗΒr γ) CH3 – (CH2)6 – CH3 δ) HF
- Nα κατατάξετε τις παρακάτω ουσίες κατά σειρά αυξανόμενου σημείου βρασμού:
α) ΗCl β) ΗΒr γ) ΗF δ) ΗΙ
Δίνονται τα Ar: H=1, F = 19, Cl = 35,5, Βr = 80, I = 127
- Nα κατατάξετε τις παρακάτω ουσίες κατά σειρά αυξανόμενου σημείου βρασμού:
α) H-C≡N β) NaF γ) CH3– OH δ) CH2 = CH2
- Nα κατατάξετε τις παρακάτω ουσίες κατά σειρά αυξανόμενου σημείου βρασμού:
α) CH3F β) CH3COONa γ) CH3 – CH3 δ) CH3NH2
5. Να συγκρίνετε τις παρακάτω ουσίες ως προς το Σημείο Βρασμού τους.
α. HCl και F2
β. CH3-OH και CH3-CH2-CH3
γ. CH3-OH και ΝaOH
δ. CH3-CH2-CH3 και CH3-CH2-CH2-CH3
ε. H2 και Ο2
στ. CH3-CH2-CH2-CH3 και CH3-CH(CH3)-CH3
ζ. ΗF και ΗΒr
η. NH3 και NH4Cl
θ. CH3-O-CH3 και CH3-CH2-OH
ι. CH3COOH και CH3COONa
ια. NH3 και NF3
ιβ. CH3OH και CH3ONa
ιγ. CH3OH και CH3CH2OH
ιδ. CH3COOH και HCOOCH3
Ημερολόγιο
Ανακοινώσεις
Όλες...- - Δεν υπάρχουν ανακοινώσεις -