Μάθημα : Χημεία Προσανατολισμού - Κεφάλαιο 1 - Παρ.1.2
Κωδικός : EL657182
EL657182 - ΜΙΧΑΗΛ ΣΜΑΡΑΓΔΑΚΗΣ
Περιγραφή Μαθήματος

ΠΡΟΣΘΕΤΙΚΕΣ ΙΔΙΟΤΗΤΕΣ
ΩΣΜΩΣΗ - ΩΣΜΩΤΙΚΗ ΠΙΕΣΗ
Προσθετικές ονομάζονται οι ιδιότητες των διαλυμάτων οι οποίες δεν εξαρτώνται από τη φύση τη διαλυμένης ουσίας (π.χ. αν είναι ιοντική, μοριακή κλπ) αλλά από την ποσότητα των διαλυμένων σωματιδίων (μορίων ή ιόντων) που υπάρχουν στο διάλυμα.
Αν και η φύση της διαλυμένης ουσίας δεν παίζει ρόλο, ωστόσο δεν πρέπει να ξεχνάμε ότι ενώ στα μοριακά διαλύματα (η διαλυμένη ουσία είναι σε μορφή μορίου) 1 mol ουσίας δίνει NA μόρια, στα ιοντικά διαλύματα η ποσότητα των σωματιδίων είναι μεγαλύτερη λόγω του ιοντισμού. Π.χ. 1 mol ΝaCl δίνει 2ΝΑ ιόντα (ΝaCl -> Na+ + Cl- ), το 1 mol Ca(NO3)2 δίνει 3ΝΑ ιόντα [Ca(NO3)2 -> Ca+2 + 2NO3- ] κλπ.
Προσθετικές ιδιότητες είναι οι:
Η ελάττωση της τάσης ατμών του διαλύτη. (Σε ένα κλειστό δοχείο που περιέχει ένα υγρό διάλυμα και ατμούς του διαλύτη σε ισορροπία, η ποσότητα του διαλύτη που είναι στην άερια φάση είναι μικρότερη όσο πιο πυκνό είναι το διάλυμα)
Η ανύψωση του Σημείου Βρασμού του διαλύτη. (Όσο πιο πυκνό είναι ένα διάλυμα τόσο αυξάνεται η θερμοκρασία στην οποία βράζει).
Η Ταπείνωση του Σημείου Τήξεως του διαλύτη. (Όσο πιο πυκνό είναι ένα διάλυμα τόσο μειώνεται η θερμοκρασία στην οποία στερεοποιείται).
Η Ωσμωτική Πίεση.
Σε ένα διάλυμα τα σωματίδια της διαλυμένης ουσίας βρίσκονται ομοιόμορφα κατανεμημένα λόγω του φαινομένου της διάχυσης, κατά το οποίο σωματίδια διαλυμένης ουσίας μετακινούνται από τα πυκνότερα σημεία του διαλύματος στα αραιώτερα μέχρι να επιτευχθεί η ομοιομορφία.
Όταν δυο διαλύματα διαφορετικής συγκέντρωσης χωρίζονται μέσω ημιπερατής μεμβράνης, η οποία επιτρέπει μόνο σε μόρια του διαλύτη να περάσουν από μέσα της, η διάχυση παρεμποδίζεται και παρατηρείται το φαινόμενο της ώσμωσης.
Σημείωση: Μπορείτε να επιλέξετε υπότιτλους και αυτόματη μετάφραση στα ελληνικά, η μετάφραση είναι ανεκτή.
Ώσμωση ονομάζεται η μεταφορά μορίων του διαλύτη διαμέσου ημιπερατής μεμβράνης από το αραιώτερο στο πυκνότερο διάλυμα έως ότου οι συγκεντρώσεις των δυο διαλυμάτων να γίνουν ίσες.

Το ίδιο μπορεί να συμβεί όταν διαχωρίζεται ένα διάλυμα από καθαρό διαλύτη. Σε αυτή την περίπτωση καθώς δεν πρόκειται ποτέ να εξισωθούν διάλυμα και διαλύτης θα έπρεπε να περάσει εξολοκλήρου ο διαλύτης μέσω της μεμβράνης στο διάλυμα. Σε αυτή την περίπτωση βέβαια ποτέ δεν θα εξισωθούν οι συγκεντρώσεις, όμως η διαφορά πίεσης θα σταματήσει το φαινόμενο καθώς ωθεί όλο και περισσότερο τα μόρια του διαλύτη προς την αντίθετη κατεύθυνση.

Ωσμωτική πίεση ονομάζεται η πίεση που πρέπει να ασκήσουμε εξωτερικά στην επιφάνεια ενός διαλύματος το οποίο διαχωρίζεται από καθαρό διαλύτη μέσω ημιπερατής μεμβράνης ώστε να μην παρατηρηθεί ώσμωση.

Η ωσμωτική πίεση Π υπολογίζεται από τον τύπο: Π = C·R·T
Όπου C η συγκέντρωση του διαλύματος σε Μ, Τ η θερμοκρασία σε Κ και R σταθερά των ιδανικών αερίων (R=0,082 L·Atm/mol·K)
Η ώσμωση ανάμεσα σε δυο διαλύματα σταματάει όταν οι ωσμωτικές πιέσεις τους γίνουν ίσες.
- Να κατατάξετε τα παρακάτω διαλύματα κατά αυξανόμενη ωσμωτική πίεση.
Α. Διάλυμα C6H12O6 0,2M B. Διάλυμα C6H12O6 18% w/v
Γ. Διάλυμα C12H22O11 0,1M Δ. . Διάλυμα C12H22O11 18% w/v
- Να κατατάξετε τα παρακάτω διαλύματα κατά αυξανόμενη ωσμωτική πίεση.
Α. Διάλυμα KBr 0,3M B. Διάλυμα Νa2S 0,3Μ
Γ. Διάλυμα Al(NO3)3 0,2M Δ. Διάλυμα C6H12O6 0,7M
- Στο ορθογώνιο δοχείο του σχήματος δυο διαλύματα χωρίζονται με κινητή ημιπερατή μεμβράνη. Το διάλυμα Α είναι μοριακό και περιέχει 90g C6H12O6 και 171g C12H22O11. Το διάλυμα Β είναι ιοντικό και περιέχει 225g ΝaI. Στο δοχείο λαμβάνει χώρα ώσμωση. Όταν το φαινόμενο σταματήσει ποια θα είναι η τελική θέση της μεμβράνης στο δοχείο;

-
Σε καθένα από τα παρακάτω ζεύγη διαλυμάτων, να τα χαρακτηρίσετε ως, υπερτονικό/υποτονικό ή ισοτονικά.
α. Δ/μα CH3OH 0,1Μ - Δ/μα CH3ONa 0,1Μ
β. Δ/μα NaCl O,1M - Δ/μα CaCl2 0,1Μ
γ. Δ/μα CaSO4 0,1M - Δ/μα Νa2SO4 0,1M
δ. Δ/μα BaCl2 0,1M - Δ/μα ΝaCl 0,2M
ε. Δ/μα CH3-CH2-OH 0,2M - Δ/μα KNO3 0,1M
στ. Δ/μα LiCl 0,4M - Δ/μα Ca(ClO4)2 0,2M
ζ. Δ/μα C6H12O6 0,1Μ - Δ/μα C12H22O11 0,1M
η Δ/μα MgCl2 0,2M - Δ/μα LiBr 0,3M -
Tο ορθογώνιο δοχείο του σχήματος χωρίζεται στη μέση με κινητή ημιπερατή μεμβράνη και είναι γεμάτο με καθαρό νερό. Προς ποια πλευρά θα μετακινηθεί η μεμβράνη (αν μετακινηθεί), αν προσθέσουμε:

α. Στην Α 58,5g NaCl και στη Β 75,5g KCl.
β. Στην Α 58,5g NaCl και στην 58,5g KCl.
γ. Στην Α 3,2g CH3OH και στην Β 4,6g CH3CH2OH.
δ. Στην Α 15,6g LiBr και στην Β 20g CaBr2.
ε. Στην Α 0,1 mol Ca(ClO4)2 και στην Β 0,1 mol KClO4.
Δίνονται τα Ar: Η=1, Li=7, C=12, Ο=16, Na=23, Cl=35,5, K=39, Ca=40, Br=80, Ι=127.
Η Ώσμωση (όπως και η διάχυση) παίζει ζωτικό ρόλο στην λειτουργία όλων των βιολογικών συστημάτων, καθώς οι πλασματικές μεμβράνες των κυττάρων είναι ημιπερατές. Η μεταφορά ουσιών με ώσμωση ή διάχυση αποτελούν παθητικούς τρόπους μεταφοράς καθώς δεν απαιτείται κατανάλωση ενέργειας. Μέσω διάχυσης για παράδειγμα γίνεται η μεταφορά οξυγόνου και απομάκρυση διοξειδίου του άνθρακα από τα κύτταρα.
Την επίδραση της Ώσμωσης μπορούμε να παρατηρήσουμε στη μορφή των ερυθρών αιμοσφαιρίων όταν αυτά τοποθετηθούν σε υποτονικό διάλυμα (δηλαδή μικρότερης ωσμωτικής πίεσης σε σχέση το εσωτερικό του κυττάρου), όπου παρατηρείται εισροή νερού στο κύτταρο που μπορεί να οδηγήσει και στην διάρρηξη της μεμβράνης του ή σε υπέρτονο διάλυμα (μεγαλύτερης ωσμωτικής πίεσης) όπου παρατηρείται συρρίκνωση του κυττάρου καθώς νερό εξέρχεται από αυτό.

Έτσι για παράδειγμα ο ορός με τον οποίο χορηγούνται ενδοφλεβίως θρεπτικές ουσίες και νερό στους ασθενείς πρέπει να είναι ισοτονικό διάλυμα ώστε να μην επηρεάζει τη μορφή των ερυθροκυττάρων.
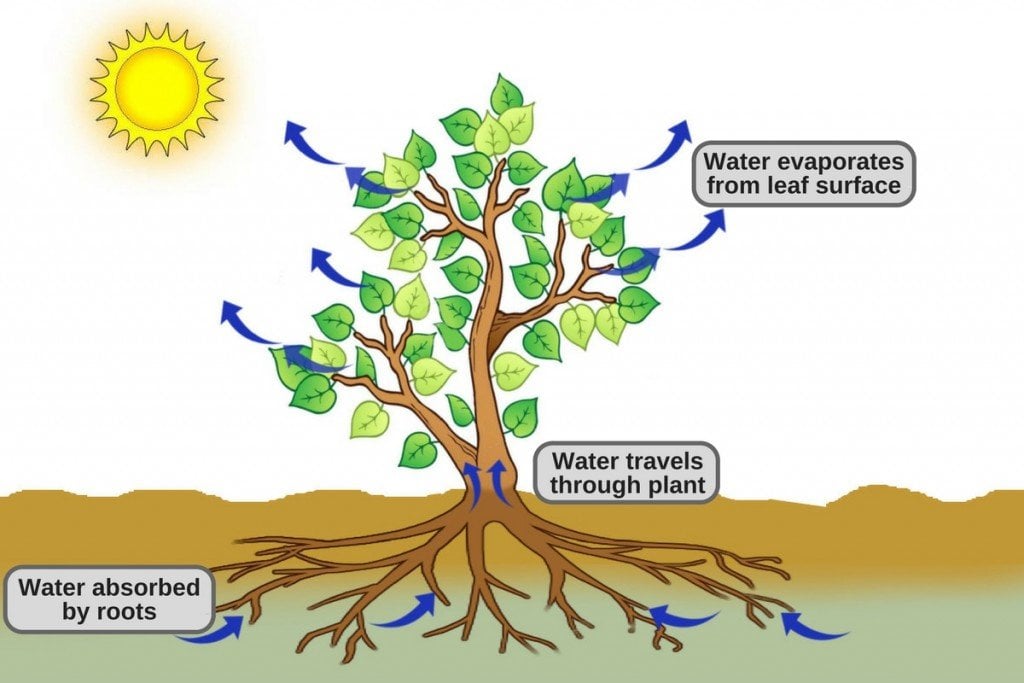
Ένα άλλο παράδειγμα είναι η μεταφορά του νερού από τις ρίζες του φυτού προς τον κορμό και τα φύλλα, κινούμενο ενάντια στην βαρύτητα.
Μελέτη της επίδρασης της ώσμωσης σε κομμάτια πατάτας τα οποία βυθίζονται σε υπερτονικά και υποτονικά διαλύματα αλατόνερου και ανάλυση των μετρήσεων.
Επίδραση της ώσμωσης σε αυγό που το κέλυφος του έχει απομακρυνθεί με αντίδραση με ξύδι. Η μεμβράνη που βρίσκεται μεταξύ τσοφλιού και ασπραδιού είναι μια ημιπερατή μεμβράνη που επιτρέπει την κίνηση του νερού αλλά όχι πρωτεϊνικών μορίων ή υδατανθράκων.
Μην ξεχνάμε! Μπορούμε να ενεργοποιήσουμε τους υπότιτλους και την αυτόματη μετάφραση στα ελληνικά!
Ημερολόγιο
Ανακοινώσεις
Όλες...- - Δεν υπάρχουν ανακοινώσεις -