Μάθημα : Χημεία Προσανατολισμού - Κεφάλαιο 2 (Β' Μέρος)
Κωδικός : EL657207
EL657207 - ΜΙΧΑΗΛ ΣΜΑΡΑΓΔΑΚΗΣ
Περιγραφή Μαθήματος
ΝΟΜΟΙ ΘΕΡΜΟΧΗΜΕΙΑΣ
Νόμος των Lavoisier- Laplace
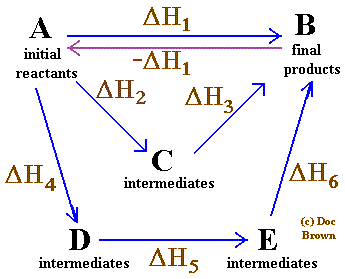
Nόμος του Hess
Aν κατά το σχηματισμό 1 mol μιας ουσίας η μεταβολή της ενθαλπίας είναι ΔΗ1, τότε κατά τη διάσπαση 1 mol της ίδιας ουσίας στα στοιχεία της η μεταβολή της ενθαλπίας είναι ΔΗ2 = -ΔΗ1.
Ο νόμος αυτός επεκτείνεται και καλύπτει όλες τις αντιδράσεις και όχι μόνο σύνθεση και διάσπαση. Mε λίγα λόγια αν γνωρίζουμε την μεταβολή της ενθαλπίας οποιασδήποτε αντίδρασης, τότε γνωρίζουμε και της αντίστροφης της. Ποσοτικά είναι ίδιες όμως αλλάζει το πρόσημο της μεταβολής καθώς αν προς την μια κατεύθυνση είναι ενδόθερμη, προς την αντίθετη είναι εξώθερμη.

Το ποσό της θερμότητας που εκλύεται ή απορροφάται κατά τη διάρκεια μιας αντίδρασης είναι το ίδια είτε γίνεται σε ένα είτε σε περισσότερα στάδια και εξαρτάται μόνο από την αρχική και τελική κατάσταση.
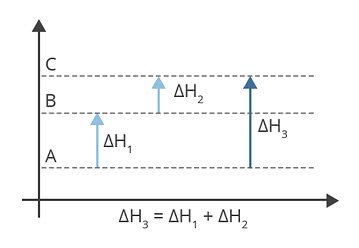
Ο νόμος αυτός μας επιτρέπει να προσθέτουμε αλγεβρικά απλούστερες χημικές εξισώσεις για να υπολογίσουμε την μεταβολή της ενθαλπίας μιας σύνθετης.

1. Κατά την αντίδραση σκόνης Ι2 με σκόνη Αl παρατηρείται σταδιακή αύξηση της θερμοκρασίας που μπορεί να οδηγήσει σε ανάφλεξη. Σύμφωνα με την παρατήρηση αυτή, σωστή πρέπει να είναι η παρακάτω θερμοχημική εξίσωση:
α) 1/2Al + 3/2I2 ⟶ AlI3 -302.9 kJ/mol
β) 1/2Al + 3/2I2⟶ AlI3 ΔΗ = 302.9 kJ/mol
γ) AlI3 ⟶ 1/2Al + 3/2I2 ΔΗ = 302.9 kJ/mol
δ) AlI3 ⟶ 1/2Al + 3/2I2 +302.9 kJ/mol
Να αιτιολογήσετε την επιλογή σας.
2. Δίνονται οι θερμοχημικές εξισώσεις για τις παρακάτω αντιδράσεις:
Καύση του γραφίτη: Cγραφίτης + Ο2(g) ⟶ CO2(g) ΔH1 = −393.5kJ/mol
Καύση του διαμαντιού: Cδιαμάντι + Ο2(g) ⟶ CO2(g) ΔH2 = −395.4kJ/mol
Καύση του Υδρογόνου: Η2(g) + ½ Ο2(g) ⟶ Η2Ο(l) ΔH3 = −285.8kJ/mol
Καύση του Αιθυλενίου: C2H6(g) + O2(g) ⟶ 2CO2(g) + 3H2O(l) ΔH4 = −3119.6 kJ/mol
α. Να υπολογίσετε την ΔΗ της μετατροπής: Cγραφίτης ⟶ Cδιαμάντι. Ποια είναι η πιο σταθερή μορφή του άνθρακα;
β. Να υπολογίσετε την ΔΗ του σχηματισμού του αιθυλενίου: 2Cγραφίτης + 3H2 ⟶ C2H6.
3. Να υπολογισθεί η ΔΗ0 της αντίδρασης 2H2S(g) + SO2(g) ⟶ 3S(s) + 2H2O(l) αν:
ΔΗf0(H2S(g)) = -0,6kJ/mol, ΔΗf0(SO2 (g)) = -296,9kJ/mol και ΔΗf0(H2O(l)) = -286kJ/mol.
Ημερολόγιο
Ανακοινώσεις
Όλες...- - Δεν υπάρχουν ανακοινώσεις -