Μάθημα : Χημεία Προσανατολισμού - Κεφάλαιο 3 (Β' Μέρος)
Κωδικός : EL657228
EL657228 - ΜΙΧΑΗΛ ΣΜΑΡΑΓΔΑΚΗΣ
Περιγραφή Μαθήματος

Παράγοντες που επηρεάζουν την ταχύτητα αντίδρασης.
Συγκέντρωση
Πίεση
Επιφάνεια Στερεών
Θερμοκρασία
Ακτινοβολίες
Καταλύτες
Ένζυμα
Όσο μεγαλύτερη είναι η συγκέντρωση των αντιδρώντων (αερίων ή διαλυμένων ουσιών), τόσο περισσότερες συγκρούσεις συμβαίνουν ανά μονάδα χρόνου, άρα και περισσότερες αποτελεσματικές συγκρούσεις. Κατά συνέπεια αύξηση της συγκέντρωσης οδηγεί σε αύξηση της ταχύτητας της αντίδρασης.
Συνέπεια αυτού είναι ότι η μεγαλύτερη ταχύτητα παρατηρείται στην αρχή της αντίδρασης καθώς στη συνέχεια οι συγκεντρώσεις των αντιδρώντων μειώνονται (εξαίρεση αποτελούν οι περιπτώσεις που έχουμε αυτοκατάλυση).
Στο παρακάτω βίντεο μπορούμε να παρατηρήσουμε τη διαφορά στην ταχύτητα αντίδρασης Θειοθειϊκού νατρίου (Na2S2O3) και Υδροχλωρίου (ΗCl) σε διαλύματα διαφορετικής συγκέντρωσης.
Όταν στα αντιδρώντα υπάρχουν αέρια, αύξηση της πίεσης με μείωση του όγκου (άρα αύξηση της συγκέντρωσης) συνεπάγεται αύξηση της ταχύτητας, σύμφωνα με όσα αναφέρθηκαν και στην προηγούμενη παράγραφο.

Όταν στα αντιδρώντα υπάρχουν στερεά, αύξηση της επιφάνειας τους οδηγεί σε αύξηση της ταχύτητας. Όσο μικρότερα κομμάτια είναι το στερεό τόσο πιο γρήγορα αντιδρά.
Η θερμοκρασία αποτελεί μέτρο της μέσης κινητικής ενέργειας των μορίων. Φυσικά δεν έχουν όλα τα μόρια την ίδια ταχύτητα (άρα και κινητική ενέργεια). Αυτό περιγράφεται στις καμπύλες Maxwell Boltzmann που απεικονίζεται η κατανομή των μορίων με βάση την ενέργεια τους. Η μορφή της καμπύλης διαφέρει ανάλογα με τη θερμοκρασία.
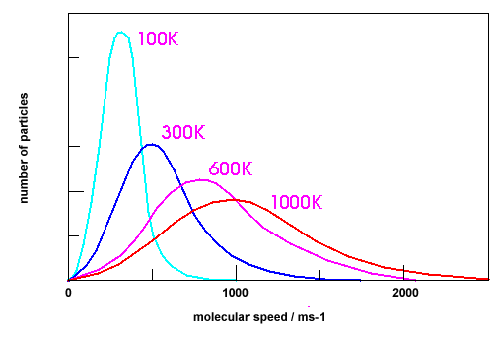
Παρατηρούμε ότι σε μικρές θερμοκρασίες οι πιθανές τιμές της κινητικής ενέργειας είναι μικρότερες κι έτσι έχουμε πολλά μόρια με παρεμφερείς τιμές (μεγάλο ύψος καμπύλης σε χαμηλή ενέργειες). Όσο οι θερμοκρασία μεγαλώνει, τόσο μεγαλώνει και το εύρος τιμών της ενέργειας που μπορεί να έχουν τα μόρια, έτσι έχουμε μεγαλύτερη διασπορά και χαμηλότερες καμπύλες, οι οποίες όμως εκτείνονται σε όλο και μεγαλύτερες τιμές. Το εμβαδόν της επιφάνειας κάτω από την καμπύλη μας δίνει τον αριθμό των μορίων. Όσο μεγαλύτερη είναι η θερμοκρασία, τόσο περισσότερα μόρια έχουν ενέργεια ίση ή μεγαλύτερη της ενέργειας ενεργοποίησης οπότε μπορούν να δώσουν αποτελεσματικές συγκρούσεις.
Κατά συνέπεια αύξηση της ταχύτητας οδηγεί πάντα σε αύξηση της ταχύτητας (εξαίρεση αποτελούν οι ενζυμικά καταλυόμενες αντιδράσεις) και μείωση της θερμοκρασίας συνεπάγεται μείωση της ταχύτητας (ανεξαιρέτως).
Αντίδραση οξείδωσης του Οξαλικού οξέος με Υπερμαγγανικό Κάλιο, σε τρεις διαφορετικές θερμοκρασίες και παρουσία καταλύτη (Mn2+).
H υπεριώδης ακτινοβολία μπορεί να σπάσει χημικούς δεσμούς, με αποτέλεσμα να διευκολύνει την αντίδραση, οπότε η ταχύτητα αυξάνεται.
Ουσίες που συμμετέχουν στην αντίδραση χωρίς να καταναλώνονται όμως. Προσφέρουν ένα εναλλακτικό ταχύτερο τρόπο για να πραγματοποιηθεί η αντίδραση. Πρακτικά μειώνουν την απαιτούμενη ενέργεια ενεργοποίησης.

Διακρίνονται οι περιπτώσεις της ομογενούς κατάλυσης (καταλύτης και αντιδρώντα στην ίδια φάση), ετερογενούς κατάλυσης (καταλύτης και αντιδρώντα σε παραπάνω από μια φάση) και της αυτοκατάλυσης (κάποιο από τα προϊόντα της αντίδρασης λειτουργεί σαν καταλύτης της).
Δεν υπάρχουν αρνητικοί καταλύτες, ο καταλύτης πάντα αυξάνει την ενέργεια της αντίδρασης.
Πρωτεΐνες που λειτουργούν ως καταλύτες στους ζωντανούς οργανισμούς (βιολογικοί καταλύτες). Σε σχέση με τους ανόργανους καταλύτες τα ένζυμα είναι πολύ πιο πολύπλοκα και βαριά μόρια, με μεγάλη εξειδίκευση ως προς την αντίδραση που καταλύουν και τις ουσίες που αντιδρούν αλλά και πολύ πιο αποτελεσματικοί. Όπως όλες οι πρωτεΐνες έτσι και τα ένζυμα είναι πολύ ευαίσθητα στις μεταβολές της θερμοκρασίας και του pH, λειτουργούν ιδανικά σε συγκεκριμένες τιμές και η λειτουργικότητα τους μειώνεται ή μηδενίζεται όσο απομακρυνόμαστε από αυτές τις τιμές.
ΠΡΟΣΟΧΗ! Οι ενζυμικά καταλυόμενες αντιδράσεις είναι οι μόνες στις οποίες μπορεί να παρατηρηθεί μείωση της ταχύτητας αντίδρασης με αύξηση της θερμοκρασίας, καθώς το ένζυμο απενεργοποιείται.
Στα παρακάτω βίντεο βλέπουμε την διάσπαση του Υπεροξειδίου του Υδρογόνου σε Οξυγόνο και Νερό. Η αντίδραση είναι αργή (Βίντεο 1), όμως μπορεί να επιταχυνθεί είτε με ανόργανους καταλύτες όπως το MnO2 (στερεό - ετερογενής κατάλυση - Βίντεο 1) ή το ΚΙ (διάλυμα - ομογενής κατάλυση - Βίντεο 2), είτε με το ένζυμο Καταλάση που βρίσκεται στο συκώτι (ενζυμική κατάλυση - Βίντεο 2).
- Να χαρακτηρίσετε τις παρακάτω προτάσεις ως σωστές ή λάθος. Να αιτιολογήσετε τις απαντήσεις σας.
α. Η ενέργεια ενεργοποίησης μιας αντίδρασης είναι μικρότερη όταν πραγματοποιείται σε μεγαλύτερη θερμοκρασία.
β. Η αύξηση της πίεσης σε ένα δοχείο που περιέχει διάλυμα Η2Ο2 θα επιταχύνει την αντίδραση 2Η2Ο2(αq) ⟶ 2Η2Ο(l) + O2(g).
γ. Η ταχύτητα της αντίδρασης 2Η2Ο2(αq) ⟶ 2Η2Ο(l) + O2(g) εξαρτάται από την περιεκτικότητα του διαλύματος σε Η2Ο2.
δ. Η ταχύτητα της αντίδρασης 2Η2Ο2(αq) ⟶ 2Η2Ο(l) + O2(g) όταν στο διάλυμα υπάρχει ΚΙ (καταλύτης της αντίδρασης) είναι μικρότερη στους 37◦C από ότι στους 77◦C.
ε. Η ταχύτητα της αντίδρασης 2Η2Ο2(αq) ⟶ 2Η2Ο(l) + O2(g) όταν στο διάλυμα υπάρχει Καταλάση (ένζυμο του συκωτιού και καταλύτης της αντίδρασης) είναι μικρότερη στους 37◦C από ότι στους 77◦C.
- Σε 3 κλειστά δοχεία των 500mL πραγματοποιείται η αντίδραση: 2Al(s) + 6ΗCl(αq) ⟶ 2AlCl3(αq) + 3H2(g) υπό διαφορετικές συνθήκες. Σε κάθε δοχείο λαμβάνονται μετρήσεις και κατασκευάζεται το διάγραμμα πίεσης στο δοχείο ως προς τον χρόνο. Να αντιστοιχήσετε τα διαγράμματα με τις συνθήκες και να αιτιολογήσετε την απάντηση σας.
α. Δοχείο Α (100 ml ΗCl 1M, 30◦C, 1g σκόνη αλουμινίου), Δοχείο Β (100 ml ΗCl 1M, 30◦C, 1g αλουμινόχαρτο), Δοχείο Γ (100 ml ΗCl 1M, 30◦C, 1 g σκόνη αλουμινίου).

β. Δοχείο Α (100 ml ΗCl 1M, 30◦C, 1g σκόνη αλουμινίου), Δοχείο Β (100 ml ΗCl 2M, 30◦C, 1g σκόνη αλουμινίου), Δοχείο Γ (100 ml ΗCl 1M, 30◦C, 1,5 g σκόνη αλουμινίου)

- Στο παρακάτω διάγραμμα φαίνεται η μεταβολή της ταχύτητας της αντίδρασης διάσπασης του Η2Ο2 ως προς το χρόνο σε τρία διαλύματα Η2Ο2 που περιέχουν το ένζυμο Καταλάση (το οποίο καταλύει την αντίδραση αυτή). Το διάλυμα Α είναι στους 17◦C, το Β στους 37◦C και το Γ 57◦C. Το ένζυμο αυτό υπάρχει στα υπατικά κύτταρα και δρα ιδανικά σε θερμοκρασία σώματος (~37◦C).Ποια καμπύλη ανήκει σε ποιο διάλυμα; Να αιτιολογήσετε.

Ημερολόγιο
Ανακοινώσεις
Όλες...- - Δεν υπάρχουν ανακοινώσεις -