Μάθημα : Χημεία Προσανατολισμού - Κεφάλαιο 5 (Μέρος Δ')
Κωδικός : EL657255
EL657255 - ΜΙΧΑΗΛ ΣΜΑΡΑΓΔΑΚΗΣ
Η πλατφόρμα σάς ανακατεύθυνε αυτόματα στην αρχική σελίδα για να συνδεθείτε προτού προχωρήσετε σε άλλες ενέργειες. Πιθανόν, να έληξε η σύνοδός σας.
Περιγραφή Μαθήματος

Αυτοϊοντισμός του Νερού
Κλίμακα pH
Στο καθαρό νερό όπως και σε όλα τα υδατικά διαλύματα, πραγματοποιείται η αντίδραση:
Η2Ο + Η2Ο ⟷ Η3Ο+ + ΟΗ- (ΔΗ>0)
η οποία έχει σταθερά ισορροπίας: Κw = [H3O+][OH-] και στους 25◦C είναι ίση με 10-14. Προφανώς η ισορροπία είναι μετατοπισμένη προς την πλευρά του Η2Ο και ελάχιστα μόρια του νερού ιοντίζονται.
H αντίδραση αυτή απεικονίζεται στο παρακάτω βίντεο:
Ένα πιο λεπτομερές βίντεο, αλλά ίσως λιγότερο κατανοητό, στο οποίο βλέπουμε πιο ρεαλιστικά τη συμπεριφορά των ατόμων του νερού αλλά και την επίδραση των δεσμών υδρογόνου είναι το παρακάτω.
Υπενθυμίζεται ότι μπορείτε να ενεργοποιείτε τους υπότιτλους και να επιλέγετε στη συνέχεια αυτόματη μετάφραση στα Ελληνικά.
Οπότε στο νερό και σε όλα τα υδατικά διαλύματα υπάρχουν έστω και λίγα [H3O+] και [OH-]. Για την ευκολότερη έκφραση της συγκέντρωσης τους δημιουργήθηκε η κλίμακα του pH και ορίστηκαν το pH=-log[H3O+] και το pOH=-log[OH-].
Στο καθαρό νερό, η μόνη πηγή [H3O+] και [OH-] είναι το ίδιο το νερό μέσω του αυτοϊοντισμού του, κατά συνέπεια από τη στοιχειομετρία της αντίδρασης προκύπτει ότι [H3O+]=[OH-]. Στους 25◦C όπου η Kw=10-14, [H3O+]=[OH-]=10-7 και pH=pOH=7.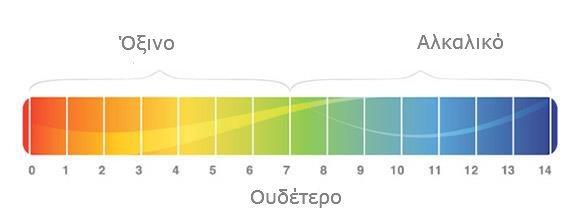
Tα διαλύματα στα οποία ισχύει [H3O+]=[OH-] χαρακτηρίζονται ως ΟΥΔΕΤΕΡΑ. Η συνθήκη αυτή ισχύει για όλες τις θερμοκρασίες, μόνο όμως στους 25◦C ισχύει ότι pH=7 καθώς σε άλλες θερμοκρασίες μεταβάλλεται η Kw (αυξάνεται με την αύξηση της θερμοκρασίας).
Ουσίες που δρουν ως οξέα στο υδατικό τους διάλυμα, παράγουν Η3Ο+ αυξάνοντας τη συγκέντρωσή [H3O+]. Κατά συνέπεια η συγκέντρωση των [OH-] μειώνεται, ώστε το γινόμενο [H3O+][OH-] να παραμείνει σταθερό. Έτσι στα ΟΞΙΝΑ ΔΙΑΛΥΜΑΤΑ [H3O+]>[OH-], και στους 25◦C αυτό συνεπάγεται ότι [H3O+]>10-7 άρα pH<7 και [OH-]<10-7 άρα pOH>7.
Το αντίθετο ισχύει για διαλύματα ουσιών που δρουν σαν βάσεις στα υδατικά τους διαλύματα οπότε παράγονται ΟΗ-. Στα ΒΑΣΙΚΑ ΔΙΑΛΥΜΑΤΑ [H3O+]<OH-], και στους 25◦C αυτό συνεπάγεται ότι [H3O+]<10-7 άρα pH>7 και [OH-]>10-7 άρα pOH<7.
Επίσης από τα παραπάνω προκύπτει ότι pH + pOH = 14 στους 25◦C.

Προσθήκη ποσότητας οξέος σε ένα διάλυμα έχει σαν αποτέλεσμα μείωση του pH καθώς αυτό αυξάνει την [H3O+]. ΠΡΟΣΟΧΗ – προσθήκη οξέος όχι διαλύματος οξέος!
Προσθήκη ποσότητας βάσης σε ένα διάλυμα έχει σαν αποτέλεσμα αύξηση του pH καθώς αυτό αυξάνει την [ΟΗ-] άρα μειώνει την [H3O+]. ΠΡΟΣΟΧΗ – προσθήκη βάσης όχι διαλύματος βάσης!
Προσθήκη νερού σε ένα διάλυμα μεταβάλει την τιμή του pH φέρνοντας την πιο κοντά στου ουδέτερου (7 στους 25◦C) . Δηλαδή αυξάνει το pH σε ένα όξινο διάλυμα και μειώνει το pH σε ένα βασικό.
Από την ανάμιξη δυο διαλυμάτων ίδιου pH σε οποιαδήποτε αναλογία, προκύπτει διάλυμα του ίδιου pH.
Από την ανάμιξη δυο διαλυμάτων διαφορετικού pH σε οποιαδήποτε αναλογία, προκύπτει διάλυμα με τιμή pH ανάμεσα στις τιμές pH των αρχικών διαλυμάτων.
Σε κάθε περίπτωση για να κρίνουμε αν ένα διάλυμα είναι όξινο, βασικό ή ουδέτερο πρέπει να αναγνωρίσουμε τους ηλεκτρολύτες που υπάρχουν σε αυτό και ποιοι από αυτούς αντιδρούν με το νερό σαν οξέα και ποιοι σαν βάσεις.
To pH μπορεί να μετρηθεί χονδρικά με τη χρήση πεχαμετρικού χαρτιού, ενώ όταν απαιτείται μεγαλύτερη ακρίβεια με ηλεκτρονικό πεχάμετρο. Στο επόμενο βίντεο παρουσιάζονται οι διαφορετικές μεθόδοι μέτρησης.
- Nα επιλέξετε τη σωστή απάντηση στις παρακάτω προτάσεις:
α. H Κw στους 15◦C μπορεί να έχει τιμή: α. 10-13,6 β. 10-14 γ. 10-14,4
β. Ένα ουδέτερο διάλυμα στους 15◦C έχει: α. pH = 7,2 β. pH = 7 γ. pH = 6,8
γ. Ένα διάλυμα ΗF στους 15◦C μπορεί να έχει: α. pH = 7 β. pH = 7,2 γ. pH = 7,4
δ. Με αραίωση αυτού του διαλύματος HF με νερό μπορεί να προκύψει διάλυμα με pH:
α. pH = 7 β. pH = 7,1 γ. pH = 7,2
ε. Προσθήκη διαλύματος με pH 7,5 στο αραιωμένο διάλυμα μπορεί να μεταβάλει τη τιμή του pH σε: α. pH = 7 β. pH = 7,1 γ. pH = 7,2
στ. Στη συνέχεια προσθήκη ποσότητας HCl θα έχει σαν αποτέλεσμα η τιμή του pH να γίνει:
α. pH = 7 β. pH = 7,2 γ. pH = 7,4
- Να χαρακτηρίσετε τις παρακάτω προτάσεις ως Σωστές ή Λάθος και να αιτιολογήσετε.
α. Αν σε διάλυμα ΝΗ3 προσθέσουμε διάλυμα ΗCl το pH οπωσδήποτε θα μειωθεί.
β. Αν σε διάλυμα ΝΗ3 προσθέσουμε διάλυμα ΝαΟΗ το pH οπωσδήποτε θα αυξηθεί.
γ. Αν σε διάλυμα ΝΗ3 προσθέσουμε νερό το pH οπωσδήποτε θα μειωθεί.
δ. Ένα διάλυμα HF γίνεται πάντα περισσότερο όξινο αν προσθέσουμε ποσότητα ΗCl.
ε. Ένα διάλυμα ΚΟΗ γίνεται πάντα λιγότερο βασικό αν προσθέσουμε νερό.
στ. Ένα διάλυμα ΝαΟΗ γίνεται πάντα πιο βασικό αν προσθέσουμε ένα διάλυμα ΚΟΗ.
ζ. Είναι δυνατό να προσθέσουμε δ/μα ΗCl σε ένα διάλυμα CH3COOH χωρίς να μεταβληθεί το pH.
η. Είναι δυνατό να προσθέσουμε διάλυμα ΝΗ3 σε ένα διάλυμα ΗCl χωρίς να μεταβληθεί το pH.
θ. Είναι δυνατό να προσθέσουμε νερό σε ένα διάλυμα CH3COOH χωρίς να μεταβληθεί το pH.
Ημερολόγιο
Ανακοινώσεις
Όλες...- - Δεν υπάρχουν ανακοινώσεις -