Μάθημα : Χημεία Α' Λυκείου - Εισαγωγή: 'Ατομα - Ισότοπα - Ιόντα - Μόρια - Χημικά στοιχεία & Χημικές Ενώσεις
Κωδικός : EL657275
EL657275 - ΜΙΧΑΗΛ ΣΜΑΡΑΓΔΑΚΗΣ
Περιγραφή Μαθήματος

Τα σημαντικά τμήματα από το 1ο κεφάλαιο του βιβλίου, προαπαιτούμενα για τη συνέχεια.
Η ιδέα του ατόμου υπάρχει από την αρχαιότητα όταν την ύπαρξη του φαντάστηκαν πρώτοι ο Λεύκιππος και ο Δημόκριτος. Στο παρακάτω βίντεο μπορείτε να δείτε μια εξαιρετική ανασκόπηση της εικόνας που είχε ο άνθρωπος από τότε μέχρι και σήμερα. Για τις ανάγκες της Α' Λυκείου το μοντέλο του Bohr είναι επαρκές, αν και η πραγματικότητα είναι πολύ πιο πολύπλοκη αλλά και πιο εντυπωσιακή...
Αυτά που χρειάζεται να κρατήσουμε εμείς συνοψίζονται στο παρακάτω πινακάκι:

Για να περιγράψουμε ένα άτομο χρειαζόμαστε δυο αριθμούς: 
Τον Ατομικό Αριθμό (Ζ): μας λέει πόσα είναι τα πρωτόνια (p) στον πυρήνα του ατόμου. Γράφεται κάτω αριστερά σε ένα άτομο, π.χ. 8Ο
Τον Μαζικό Αριθμό (Α): μας λέει πόσα είναι συνολικά πρωτόνια (p) και νετρόνια (n) στον πυρήνα του ατόμου. Γράφεται πάνω αριστερά σε ένα άτομο π.χ. 12C.
Ξέροντας αυτούς του δυο αριθμούς μπορούμε να υπολογίσουμε όλα τα συστατικά του ατόμου:
Άμεσα τα πρωτόνια αφού τα αναφέρει ο Ατομικός Αριθμός.
Έμμεσα τα ηλεκτρόνια αφού είναι ίσα με τα πρωτόνια σε ένα άτομο (αφού είναι ηλεκτρικά ουδέτερο τα θετικά φορτισμένα πρωτόνια πρέπει να είναι ίσα με τα αρνητικά φορτισμένα ηλεκτρόνια).
Έμμεσα τα νετρόνια αφαιρώντας τον Ατομικό Αριθμό από τον Μαζικό Αριθμό.
Παράδειγμα
![]()
περιέχει 11 πρωτόνια όπως φαίνεται κάτω αριστερά, άρα και 11 ηλεκτρόνια που είναι ίσα με τα πρωτόνια. Τα νετρόνια είναι 21-11=10.
Επιπλέον ο Ατομικός Αριθμός έχει και άλλο ένα σημαντικό ρόλο: αποτελεί την ταυτότητα ενός ατόμου, μας λέει δηλαδή τι άτομο είναι. Π.χ. τα άτομα με Ζ=6 είναι άτομα C (Άνθρακα), ενώ τα άτομα με Ζ=8 είναι άτομα Ο (Οξυγόνου).
Δύο άτομα C έχουν δηλαδή πάντα τον ίδιο αριθμό πρωτονίων, ωστόσο μπορεί να έχουν διαφορετικό αριθμό νετρονίων (άρα διαφορετικό Μαζικό αριθμό). Έτσι ενώ υποχρεωτικά όλα τα άτομα Άνθρακα είναι 6C, υπάρχουν άτομα 12C, 13C, 14C τα οποία μεταξύ τους χαρακτηρίζονται ως Ισότοπα.
Ενώ τα πρωτόνια και τα νετρόνια συγκρατούνται με ισχυρές δυνάμεις στον πυρήνα του ατόμου, τα ηλεκτρόνια που περιφέρονται γύρω από αυτόν έχουν την δυνατότητα να φύγουν από ένα άτομο και να μεταφερθούν σε ένα άλλο, ένα αρκετά συχνό φαινόμενο στη φύση. Αυτό όμως έχει σαν αποτέλεσμα να χαλάσει η ισορροπία ηλεκτρικού φορτίου που υπήρχε. Έτσι στη φύση συχνά συναντάμε σωματίδια τα οποία έχουν θετικό ή αρνητικό φορτίο και ονομάζονται Ιόντα.
Όταν ένα άτομο χάσει ένα ή περισσότερα ηλεκτρόνια, αποκτά θετικό φορτίο (εφόσον πλέον τα πρωτόνια είναι περισσότερα) και ονομάζεται Κατιόν. Συμβολίζεται δε με ένα +, +2, +3 πάνω δεξιά ανάλογα με πόσα ηλεκτρόνια έχει χάσει. Π.χ. Νa+, Mg+2 ή Mg2+, Al+3 ή Al3+.
Όταν ένα άτομο προσλάβει ένα ή περισσότερα ηλεκτρόνια, αποκτά αρνητικό φορτίο (εφόσον πλέον τα ηλεκτρόνια είναι περισσότερα) και ονομάζεται Ανιόν. Συμβολίζεται δε με ένα -, -2, -3 πάνω δεξιά ανάλογα με πόσα ηλεκτρόνια έχει πάρει. Π.χ. F-, S-2 ή S2-, N-3 ή N3-.
Στα ιόντα τα πρωτόνια και τα νετρόνια υπολογίζονται όπως και στα ουδέτερα άτομα από τα Ζ και Α. Για τον υπολογισμό των ηλεκτρονίων όμως πρέπει να ληφθεί υπόψιν και το φορτίο:
Στα κατιόντα που έχουν + φορτίο, αφαιρούμε τόσα ηλεκτρόνια όσα είναι το φορτίο.
Στα ανιόντα που έχουν - φορτίο, προσθέτουμε τόσα ηλεκτρόνια όσα είναι το φορτίο.
Παραδείγματα:
17Cl-: Z=17 και Φορτίο=-1 άρα e= 17+1 = 18
13Al+3: Z=13 και Φορτίο=+3 άρα e= 13-3 = 10
Τα παραπάνω μπορείτε να δείτε αναλυτικά στο βίντεο που ακολουθεί. Μην ξεχνάτε ότι σε όλα τα βίντεο μπορείτε να ενεργοποιήσετε ελληνικούς υπότιτλους ως εξής:
Πατάτε στο γραναζάκι κάτω δεξιά και επιλέγετε Υπότιτλοι-> Αγγλικά (αυτόματα), ξανά Υπότιτλοι - > Αυτόματη μετάφραση -> Ελληνικά.
Στον παρακάτω σύνδεσμο υπάρχει ένα εξαιρετικό πρόγραμμα στο οποίο μπορείτε να εξασκηθείτε παίζοντας στους υπολογισμούς με τα άτομα και τα ιόντα και να κατανοήσετε καλύτερα το ρόλο των σωματιδίων του ατόμου:
Τα άτομα σπάνια συναντόνται μόνα τους στη φύση. Συνήθως σχηματίζουν ομάδες ατόμων, τα μόρια.
Μόριο ονομάζουμε το μικρότερο συστατικό μιας χημικής ουσίας που μπορεί να υπάρξει ελεύθερο στη φύση και να παρουσιάζει τις ιδιότητες της ουσίας αυτής.
Οι χημικές ουσίες περιγράφονται από τον Μοριακό Τύπο ο οποίος αναφέρει το είδος και τον αριθμό των ατόμων από τα οποία αποτελείται ένα μόριο της ουσίας αυτής. Π.χ. το νερό έχει σαν χημικό τύπο H2O, το οποίο σημαίνει ότι ένα μόριο νερού (η μικρότερη ποσότητα νερού που μπορεί να υπάρχει) αποτελείται από 2 άτομα Η (Υδρογόνου) και 1 άτομο Ο (οξυγόνου).
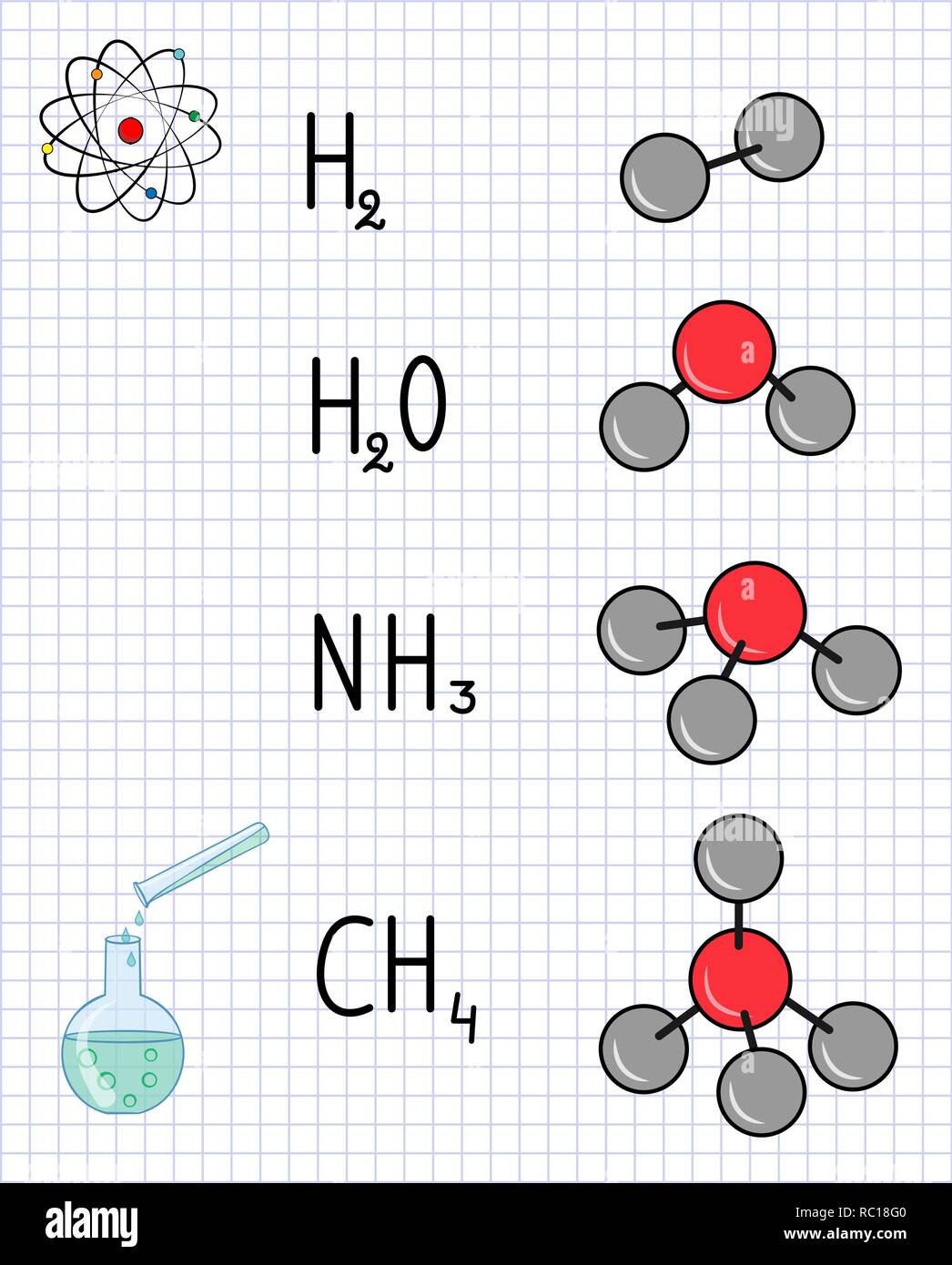
Οι χημικές ουσίες χωρίζονται σε δυο κατηγορίες:
Τα χημικά στοιχεία, των οποίων τα μόρια αποτελούνται από ένα είδος ατόμου, π.χ. Η2, Ο2, Ο3, He, Cl2.
Τις χημικές ενώσεις, οι οποίες αποτελούνται από δύο ή περισσότερα είδη ατόμων,
π.χ. Η2Ο, CaCO3, C6H12O6.

Ημερολόγιο
Ανακοινώσεις
Όλες...- - Δεν υπάρχουν ανακοινώσεις -
