Μάθημα : Χημεία Α' Λυκείου - 2ο Κεφάλαιο - Χημικοί Δεσμοί
Κωδικός : 1251060328
-
Θεματικές Ενότητες
Ιοντικός ή ετεροπολικός Δεσμός
Ο ιοντικός δεσμός σχηματίζεται συνήθως ανάμεσα σε άτομα που θέλουν να αποβάλλουν ηλεκτρόνια και άτομα που θέλουν να προσλάβουν ηλεκτρόνια, δηλαδή ανάμεσα σε μέταλλα και αμέταλλα. Η παρουσία μετάλλου σε μια ουσία φανερώνει την ύπαρξη ιοντικού δεσμού. Καθώς το μέταλλο αποβάλλει ένα ή περισσότερα ηλεκτρόνια φορτίζεται θετικά ενώ το αμέταλλο αρνητικά. Τα κατιόντα και τα ανιόντα που δημιουργούνται από τη μεταφορά ηλεκτρονίων έλκονται με δυνάμεις Coulomb και συγκρατούνται μεταξύ τους.

Ιοντικές ενώσεις είναι κατά κύριο λόγο οξείδια μετάλλων (Να2Ο, MgO, Fe2O3), υδροξείδια μετάλλων (ΝαΟΗ, ΚΟΗ, Βα(ΟΗ)2) και άλατα. Εκτός από τα κατιόντα μετάλλων ένα σύνηθες κατιόν είναι το κατιόν του αμμωνίου (ΝΗ4+) που είναι πολυατομικό κατιόν. Πολυατομικά μπορεί να είναι και τα ανιόντα, τα οποία θα γνωρίσουμε παρακάτω (π.χ. θειϊκό SO42-)


Οι ιοντικές ουσίες είναι κρύσταλλοι οι οποίοι αποτελούνται από κατιόντα και ανιόντα στοιχισμένα με τέτοιο τρόπο ώστε τα θετικά να περιστοιχίζονται από αρνητικά και το αντίθετο. Δεν διακρίνονται μόρια.
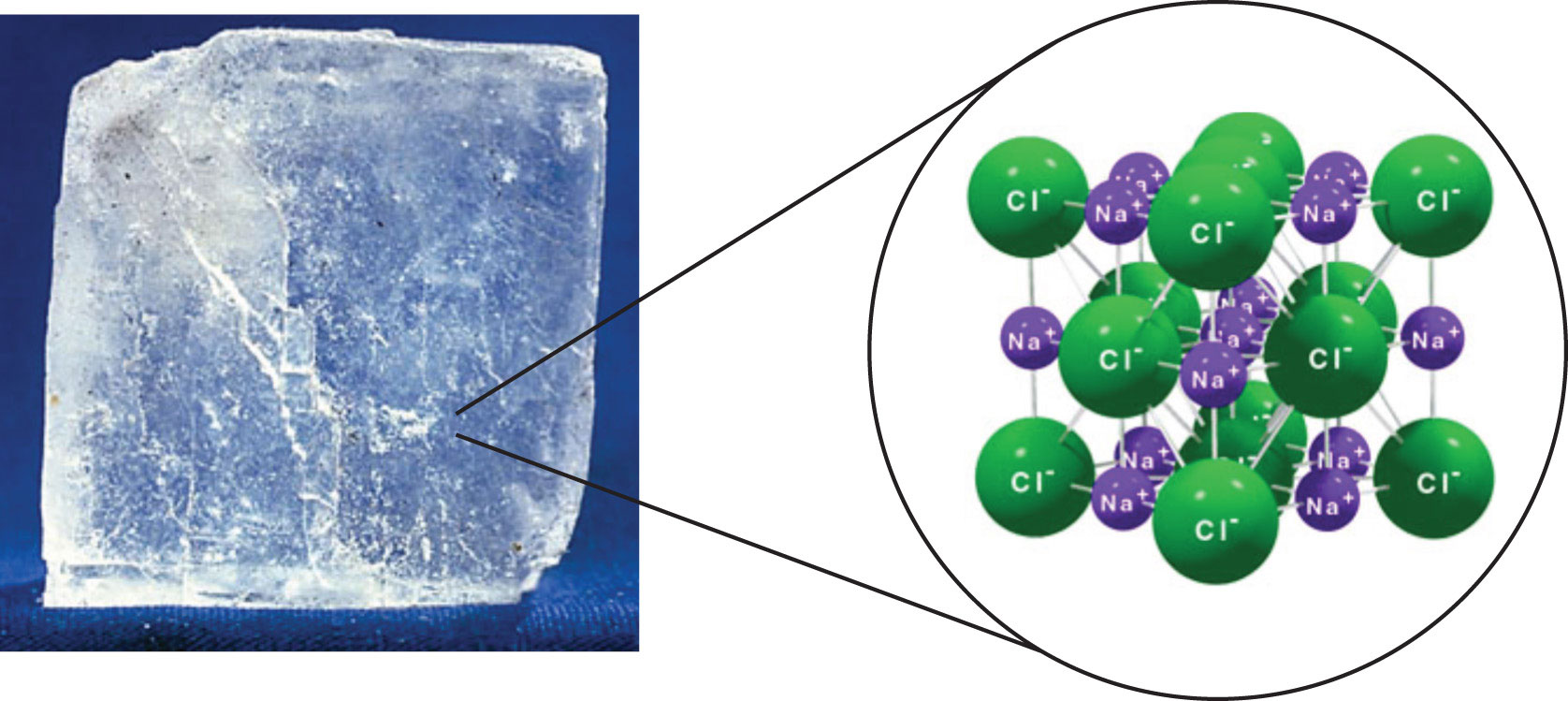
Οι δυνάμεις Coulomb που συγκρατούν τα ιόντα μεταξύ τους είναι αρκετά ισχυρές και τα συγκρατούν σταθερά στον κρύσταλλο, αυτό έχει σαν αποτέλεσμα οι περισσότερες ουσίες να είναι στερεά με υψηλά σημεία τήξεως, ενώ είναι σκληρά αλλά εύθραυστα υλικά. Σε στέρεη κατάσταση είναι κακοί αγωγοί του ηλεκτρισμού, όμως λιωμένα (τήγματα) άγουν τον ηλεκτρισμό. Οι ιοντικές ενώσεις είναι γενικά ευδιάλυτες στο νερό και τα υδατικά διαλύματά τους άγουν τον ηλεκτρισμό.