Μάθημα : Χημεία Α' Λυκείου - 2ο Κεφάλαιο - Χημικοί Δεσμοί
Κωδικός : 1251060328
-
Θεματικές Ενότητες
Ομοιοπολικός Δεσμός
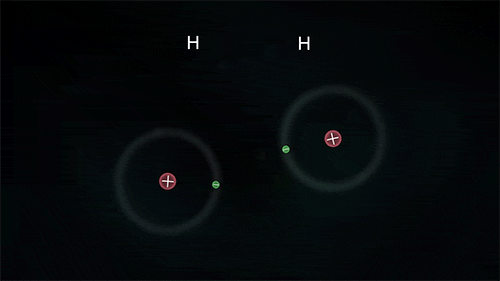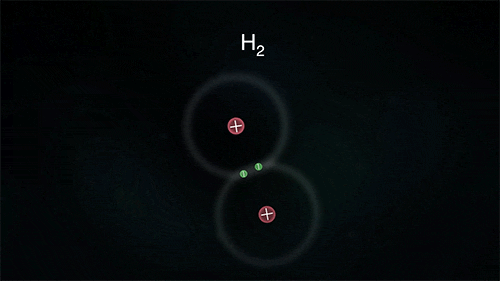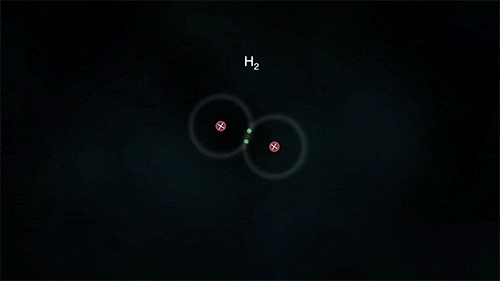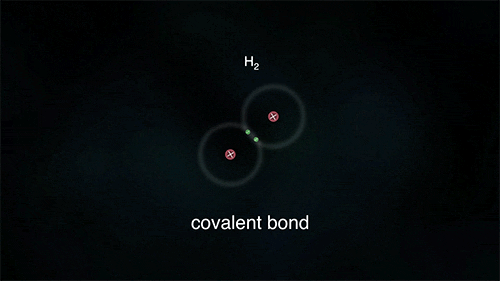
Ανάμεσα σε αμέταλλα, τα οποία θέλουν να αποκτήσουν ηλεκτρόνια, σχηματίζεται ένα διαφορετικό είδος δεσμού που ονομάζεται ομοιοπολικός. Τα άτομα μοιράζονται από κοινού κάποιο ή κάποια από τα ηλεκτρόνιά τους, τα "χρησιμοποιούν" δηλαδή και τα δυο.
Στον απλό ομοιοπολικό δεσμό, τα άτομα μοιράζονται ένα ζευγάρι ηλεκτρονίων (συνήθως ένα προέρχεται από το ένα άτομο και ένα από το άλλο) και ανήκουν και στα δυο. Μπορούν όμως να μοιράζονται δύο ζεύγη (διπλός δεσμός) ή και τρία ζεύγη ηλεκτρονίων (τριπλός δεσμός). Με αυτό τον τρόπο τα άτομα "κερδίζουν" επιπλέον ηλεκτρόνια αφού θεωρούν δικά τους και τα ηλεκτρόνια που μοιράζεται μαζί τους το άλλο άτομο, χωρίς όμως να μετατρέπονται σε ιόντα.

Όταν τα άτομα που συνδέονται είναι ίδια τότε τα ηλεκτρόνια ανήκουν εξίσου και στα δυο άτομα και ο δεσμός χαρακτηρίζεται ως Μη Πολικός Ομοιοπολικός. Όταν όμως τα άτομα που συνδέονται είναι διαφορετικά, το ένα έλκει τα κοινά ηλεκτρόνια πιο ισχυρά από το άλλο, οπότε βρίσκονται στον χώρο του περισσότερη ώρα. Ο δεσμός αυτός χαρακτηρίζεται ως Πολικός ομοιοπολικός καθώς το άτομο που έλκει ισχυρότερα τα ηλεκτρόνια εμφανίζεται να έχει μερικό αρνητικό φορτίο και το αδύναμο θετικό, οπότε παρατηρούνται θετικός και αρνητικός πόλος στον δεσμό. Ηλεκτραρνητικότητα ονομάζεται το μέτρο της ισχύος που έλκει ένα άτομο τα ηλεκτρόνια, όσο πιο ισχυρά τα έλκει τόσο πιο ηλεκτραρνητικό είναι.

Στην πραγματικότητα δεν υπάρχουν δεσμοί 100% ομοιοπολικοί και 100% ιοντικοί καθώς τα ηλεκτρόνια κινούνται παντού στο χώρο. Ο διαχωρισμός σε ομοιοπολικό και ιοντικό δεσμό υποδηλώνει που βρίσκονται τον περισσότερο χρόνο τα ηλεκτρόνια.