Μάθημα : Χημεία Προσανατολισμού - Κεφάλαιο 6 (Μέρος Α')
Κωδικός : 1251060392
-
Θεματικές Ενότητες
Φύση της Ύλης
Ένα άλλο ερώτημα το οποίο προσπάθησαν να απαντήσουν οι αρχαίοι Έλληνες φιλόσοφοι ήταν από τι είναι φτιαγμένη η ύλη. Ο Λεύκιππος και ο μαθητής του ο Δημόκριτος ισχυρίστηκαν ότι τα πάντα γύρω μας αποτελούνται από απειροελάχιστα κομματάκια ύλης τα οποία δεν μπορούν να κοπούν σε μικρότερα μέρη, τα άτομα, και από το κενό. Η θεωρία αυτή επισκιάστηκε από τις διαφορετικές αντιλήψεις του Αριστοτέλη που θεωρούνταν αυθεντία.
Η θεωρία του ατόμου θα ξαναέρθει στο προσκήνιο γύρω στο 1800 από τα πειράματα που διεξήγαγε ο John Dalton πάνω στη συμπεριφορά των αερίων. Τελικά η ύπαρξη του ατόμου θα "επιβεβαιωθεί" ένα αιώνα αργότερα από τον J.J. Thomson ο οποίος ανακάλυψε την ύπαρξη των ηλεκτρονίων. Ουσιαστικά ανακάλυψε ότι το άτομο, που περιέγραψε σαν μια ενιαία αδιαίρετη οντότητα ο Δημόκριτος, αποτελείται από μικρότερα κομμάτια.
O Thomson παρατήρησε ότι εφαρμόζοντας σε ένα σωλήνα Crook (σωλήνα κενού) διαφορά δυναμικού στα δυο ηλεκτρόδια που υπήρχα στα άκρα του, δημιουργήθηκε μια ακτίνα φωτός, η οποία πρέπει να αποτελούνταν από σωματίδια κάποιας μάζας (τα οποία συγκρουόμενα με ένα στρόβιλο που υπήρχε μέσα τον έθεταν σε κίνηση) που είχαν αρνητικό φορτίο (καθώς η ακτίνα άλλαζε κατεύθυνση όταν πλησίαζε ένας μαγνήτης σε αυτήν).
Ο Thomson ονόμασε τα σωματίδια ηλεκτρόνια και τιμήθηκε με βραβείο Nobel για την ανακάλυψή του αυτή. Περιέγραψε το άτομο σαν ένα σταφιδόψωμο στο οποίο το θετικό φορτίο ήταν απλωμένο όπως η ζύμη και τα ηλεκτρόνια βρίσκονταν τυχαία μέσα σε αυτό όπως οι σταφίδες. Το μοντέλο αυτό καταρρίφθηκε σύντομα (1906) από τον Ernest Rutherford τα πειράματα του οποίου έδειξαν ότι το θετικό φορτίο πρέπει να είναι συγκεντρωμένο σε ένα σημείο στο κέντρο του ατόμου, τον πυρήνα. Το 1914 ο Rutherford οδηγήθηκε στο συμπέρασμα ότι και ο πυρήνας αποτελείται από μικρότερα σωματίδια με θετικό φορτίο τα οποία ονόμασε πρωτόνια. Τιμήθηκε και αυτός για τη συνεισφορά του με το βραβείο Nobel. Πολύ αργότερα (1932) ανακαλύφθηκαν και τα ουδέτερα σωματίδια του πυρήνα, τα νετρόνια, από τον Sir James Chadwick και φυσικά απομενήθηκε και σε αυτόν το Nobel.
Ο Rutherford πρότεινε για το άτομο το "πλανητικό πρότυπο" όπου ο πυρήνας βρίσκεται στο κέντρο και τα ηλεκτρόνια κινούνται γύρω του σε τροχιές όπως οι πλανήτες γύρω από τον ήλιο. Σχεδόν όλη η μάζα του ατόμου είναι συγκεντρωμένη στον πυρήνα. Ανάμεσα στον πυρήνα και τα ηλεκτρόνια υπάρχει κενό. Τα ηλεκτρόνια δεν μπορούν να είναι ακίνητα καθώς θα έπεφταν στον πυρήνα, ωστόσο το μοντέλο του Rutherford παρουσίαζε άλλα προβλήματα και δεν άργησε κι αυτό να αντικατασταθεί από το μοντέλο του Bohr, ο οποίος ήταν μαθητής του Rutherford.
O Bohr επηρεασμένος από την ιδέα της κβάντωσης που είχαν εισαγάγει νωρίτερα οι Planck και Einstein πρότεινε την εξής βελτίωση στο μοντέλο του Rutherford: τα ηλεκτρόνια δεν μπορούσαν να κινούνται σε οποιαδήποτε τυχαία τροχιά. Για κάθε άτομο υπήρχαν συγκεκριμένες επιτρεπόμενες τροχιές στις οποίες μπορούσαν να βρεθούν τα ηλεκτρόνια τους, με συγκεκριμένη ενέργεια η κάθε τροχιά. (Οπτική Συνθήκη).
Για το άτομο του Υδρογόνου οι επιτρεπτές ενέργειες των στοιβάδων δίνονται από τον τύπο:
Εn = -2,18.10-18 / n2
όπου n είναι ο αριθμός της στοιβάδας και ονομάζεται Κύριος Κβαντικός Αριθμός.
Η αρνητική τιμή στην ενέργεια του ηλεκτρονίου έχει την φυσική έννοια ότι όσο πιο κοντά είναι ένα άτομο στον πυρήνα, τόσο μικρότερη είναι η ενέργειά του. Έτσι η μέγιστη τιμή που μπορεί να πάρει ένα ηλεκτρόνιο είναι 0, όταν αυτό πλέον έχει εγκαταλήψει το άτομο (ιοντισμός).
Για να μεταβεί ένα ηλεκτρόνιο από μια στοιβάδα σε μια με μεγαλύτερο n (άρα και μεγαλύτερη ενέργεια) πρέπει να απορροφήσει ενέργεια ίση με τη διαφορά ενέργειας ανάμεσα στις δυο στοιβάδες , ενώ όταν ένα ηλεκτρόνιο μεταβαίνει από μια στοιβάδα πιο κοντά στον πυρήνα, απελευθερώνει ενέργεια ίση με τη διαφορά ενέργειας των δυο στοιβάδων. (Οπτική συνθήκη) Η ενέργεια αυτή απελευθερώνεται με τη μορφή ενός φωτονίου, για το οποίο ισχύει:
Ε = h.f = ΔΕn = Εnτελ - Εnαρχ
Το μοντέλο του Bohr έγινε αποδεκτό, καθώς εξηγούσε το φάσμα εκπομπής του Υδρογόνου, δηλαδή το φως που εκπέμπουν διεγερμένα άτομα του Υδρογόνου (το ηλεκτρόνιο τους έχει μεταβεί σε ανώτερη από την 1η στοιβάδα απορροφώντας ενέργεια) καθώς επιστρέφουν στην θεμελιώδη κατάσταση (το e στην στοιβάδα Κ). Αντίθετα με το φάσμα του λευκού φωτός που περιέχει τις ακτινοβολίες όλων των συχνοτήτων, το φάσμα του φωτός που παράγεται από την αποδιέγερση των ατόμων υδρογόνου περιέχει μόνο φωτόνια συγκεκριμένων συχνοτήτων, τα οποία αντιστοιχούν στις ενέργειες διαφοράς των στοιβάδων του Υδρογόνου. Το μοντέλο του Bohr παρόλα αυτά, δεν μπορούσε να εξηγήσει το φάσμα εκπομπής των υπολοίπων στοιχείων, φανερώνοντας ότι κι αυτό είχε περιθώρια βελτίωσης.
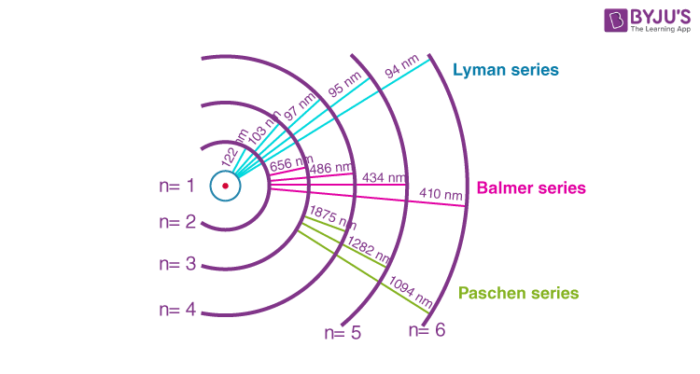
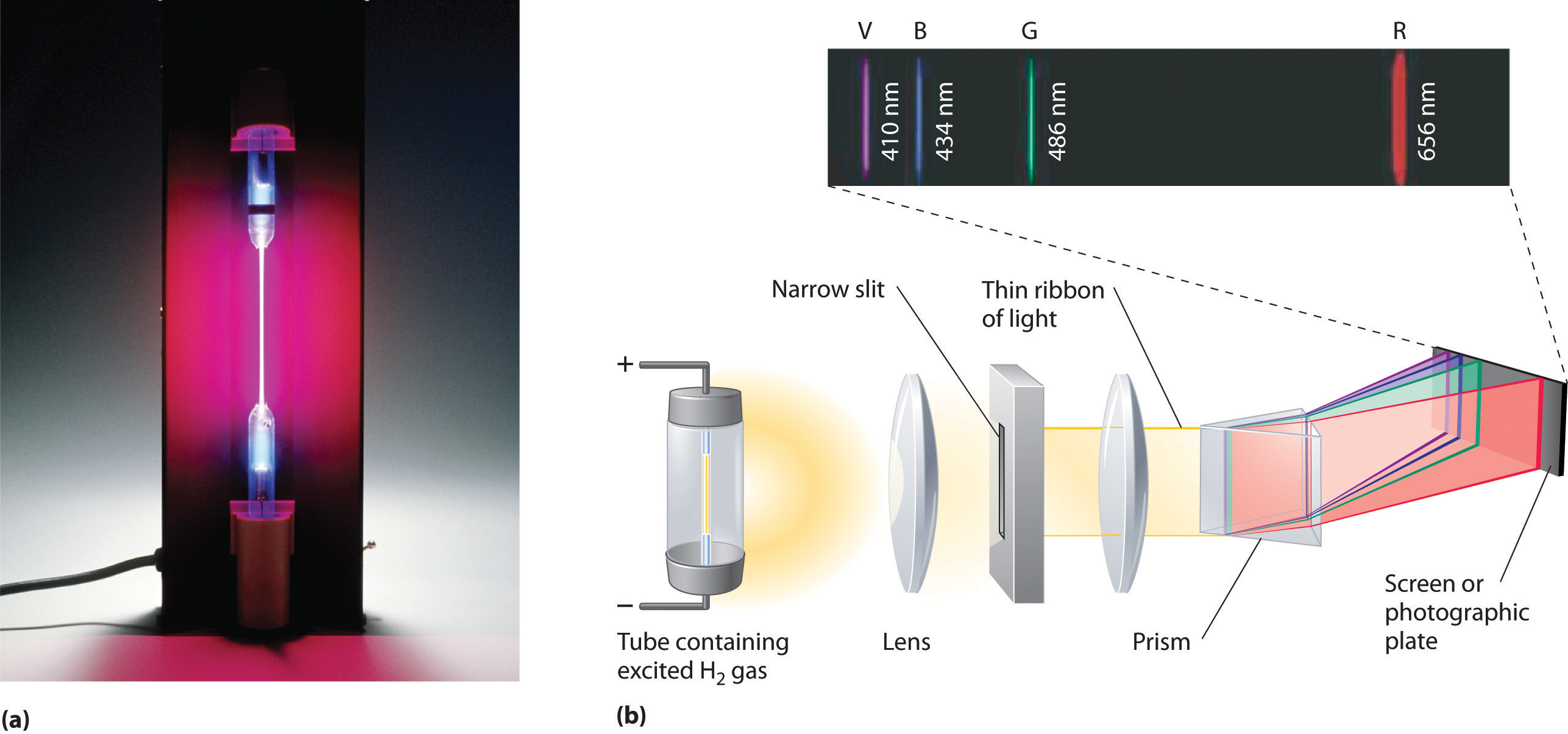 To φάσμα εκπομπής του Υδρογόνου. Να επισημάνουμε ότι οι γραμμές που φαίνονται (στο ορατό μέρος δηλαδή του φάσματος) αντιστοιχούν σε μεταβάσεις ηλεκτρονίων στη 2η στοιβάδα. Όλες οι μεταβάσεις ηλεκτρονίων προς την 1η στοιβάδα αντιστοιχούν σε φωτόνια υπεριώδους και όλες στην 3η σε φωτόνια υπερύθρου.
To φάσμα εκπομπής του Υδρογόνου. Να επισημάνουμε ότι οι γραμμές που φαίνονται (στο ορατό μέρος δηλαδή του φάσματος) αντιστοιχούν σε μεταβάσεις ηλεκτρονίων στη 2η στοιβάδα. Όλες οι μεταβάσεις ηλεκτρονίων προς την 1η στοιβάδα αντιστοιχούν σε φωτόνια υπεριώδους και όλες στην 3η σε φωτόνια υπερύθρου.
Αν και το μοντέλο του Bohr χρησιμοποιείται ακόμη και σήμερα καθώς είναι κατανοητό και εύχρηστο, ωστόσο απέχει αρκετά από την πραγματικότητα.
Το 1924 ο Γάλλος Louis de Broglie, βασισμένος στις ιδέες του Planck και του Einstein για τη διαδική φύση του φωτός, θα προτείνει τη διαδική φύση της ύλης:
Οποιοδήποτε κινούμενο σώμα εμφανίζει κυματική φύση και το μήκος κύματος του δίνεται από την εξίσωση:
λ = h / mu ή λ = h / p
η οποία συσχετίζει την κυματική φύση (μήκος κύματος λ) με την σωματιδιακή (ορμή p).
Επανάληψη του πειράματος της διπλής σχισμής με ηλεκτρόνια επαλήθευσε την υπόθεση του De Broglie και άλλαξε τελείως τον τρόπο που έβλεπαν οι επιστήμονες το άτομο.
Τα πράγματα θα αλλάξουν ακόμη περισσότερο όταν ο Werner Heisenberg θα διατυπώσει το 1925 την περίφημη Αρχή της Αβεβαιότητας του, σύμφωνα με την οποία:
Είναι αδύνατον να γνωρίζουμε με ακρίβεια ταυτόχρονα τη θέση και την ορμή ενός σωματιδίου, με όσο μεγαλύτερη ακρίβεια προσδιορίζουμε τη θέση ενός κινούμενου σωματιδίου τόσο λιγότερη ακρίβεια θα έχουμε για την ορμή του και το αντίθετο. Η αρχή αυτή εκφράζεται από τη σχέση: Δx . Δp > h/4π
Η αποδοχή της αρχής αυτής καταρρίπτει όλα τα προηγούμενα μοντέλα του ατόμου, καθώς αν τα ηλεκτρόνια κινούνται σε τροχιές τότε μπορούμε να προσδιορίσουμε με ακρίβεια τη θέση και την ορμή τους ανά πάσα στιγμή. Επομένως τα ηλεκτρόνια δεν κινούνται σε τροχές. O Ηeisenberg έχει δημιουργήσει ένα νέο τομέα στη Φυσική, την Κβαντομηχανική. Το 1933 θα τιμηθεί με το βραβείο Nobel.
Θα ακολουθήσει το 1926 η εργασία του Erwin Schrodinger στην οποία περιλαμβάνεται η περίφημη Εξίσωση του Schrodinger, μια μαθηματική περιγραφή της κυματικής φύσης των κβαντικών συστημάτων. Η κυματοσυνάρτηση του Scrodinger, που συμβολίζεται ως Ψ και ονομάζεται ως ατομικό τροχιακό προς τιμήν των τροχιών του συστήματος του Bohr, είναι μια συνάρτηση χώρου και περιγράφεται εν συντομία ως ΕΨ=ΗΨ, όπου Ε είναι η ενέργεια του σωματιδίου, Ψ η κυματοσυνάρτηση και Η ένας τελεστής.

H κυματοσυνάρτηση που περιγράφει την κίνηση ενός ελεύθερου σωματιδίου στο χώρο.
Για ένα ηλεκτρόνιο με ενέργεια Ε, αντικατάσταση στην Ψ συντεταγμένων του χώρου έχει σαν αποτέλεσμα να πάρουμε από την επίλυση της εξίσωσης μια τιμή για το Ψ. Η τιμή αυτή δεν έχει κάποια ιδιαίτερη φυσική σημασία, υψωμένη όμως στο τετράγωνο μας δίνει την πιθανότητα να βρούμε το ηλεκτρόνιο στο σημείο που το ψάχνουμε.
Η τιμή -eΨ2 ονομάζεται ηλεκτρονιακή πυκνότητα και είναι μια απεικόνιση των πιθανών θέσεων που μπορεί να βρεθεί ένα ηλεκτρόνιο. Ένα ηλεκτρόνιο μπορεί να βρίσκεται οπουδήποτε όμως, οπότε για διευκόλυνση προσδιορίζεται ο χώρος που το ηλεκτρόνιο βρίσκεται στο 90% του χρόνου. Για τους χώρους αυτούς θα χρησιμοποιούμε τον όρο Ατομικό Τροχιακό, αν και δεν πρέπει να ξεχνάμε ότι αυτό γίνεται για λόγους απλότητας, ατομικό τροχιακό είναι το Ψ και όχι το -eΨ2.
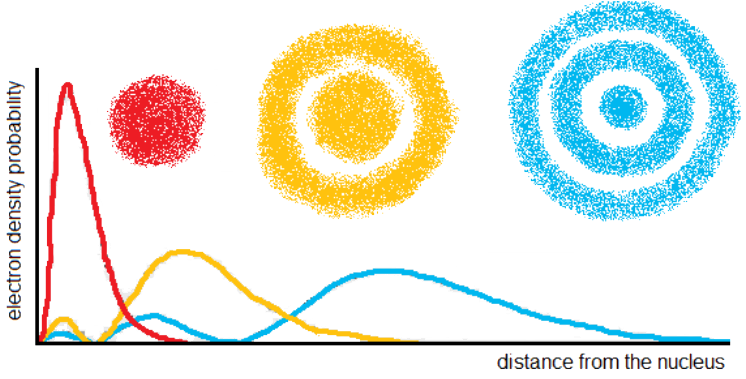
Oι χώροι αυτοί έχουν διαφορετικά σχήματα (ανάλογα με το είδος του τροχιακού) και μέγεθος (ανάλογα με την στοιβάδα - μεγαλύτερες στοιβάδες έχουν μεγαλύτερα τροχιακά). Τα χαρακτηριστικότερα σχήματα είναι των s τροχιακών που είναι σφαιρικού σχήματος και των p τροχιακών τα οποία έχουν το σχήμα "αλτήρα", φαίνονται δηλαδή σαν επιμήκη μπαλόνια που έχουν συσφιχτεί στο κέντρο και αποτελούνται από δυο "λοβούς".
Αν και υπάρχουν πολλών ειδών τροχιακά και σχήματα όπως βλέπουμε στο παρακάτω σχήμα εμάς θα μας απασχολήσουν μόνο τα δυο παραπάνω όσων αφορά το σχήμα. Στην επόμενη ενότητα θα δούμε περισσότερα για τα διάφορα είδη τροχιακών και τα χαρακτηριστικά τους.

Τέλος στο παρακάτω βίντεο μπορείτε να δείτε μια πολύ ενδιαφέρουσα περίληψη όσων συζητήσαμε στην παρούσα παράγραφο.