Μάθημα : Χημεία Προσανατολισμού - Κεφάλαιο 1 - Παρ.1.1 (Γ' μέρος)
Κωδικός : EL657155
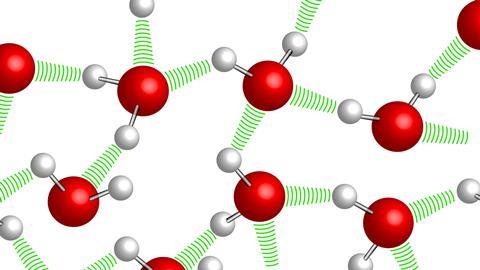
Δεσμοί Υδρογόνου
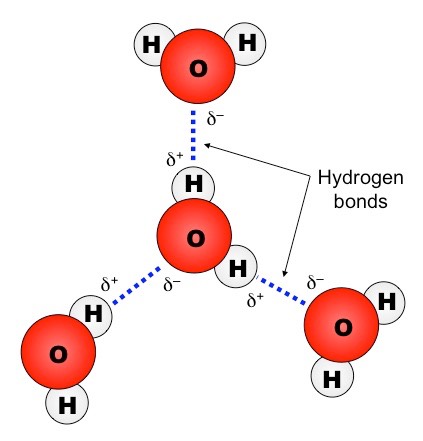
Όταν ενώνεται με ομοιοπολικό δεσμό το Η (πολύ χαμηλή ηλεκτραρνητικότητα) με ένα εκ των F, O, N (τα τρια πιο ηλεκτραρνητικά) η πόλωση του δεσμού είναι πολύ μεγάλη. Αυτό έχει σαν συνέπεια οι διαμοριακές δυνάμεις μεταξύ μορίων που περιέχουν τέτοιους δεσμούς να είναι σημαντικά ισχυρότερες από τις υπόλοιπες περιπτώσεις διπόλου – διπόλου.
Για το λόγο αυτό ξεχωρίζουμε αυτές τις δυνάμεις και τις ονομάζουμε Δεσμούς Υδρογόνου και Γέφυρες Υδρογόνου. Οι δεσμοί αυτοί σχηματίζονται αποκλειστικά μεταξύ ενός Η (ενωμένου με F, O ή Ν) και ενός F, O, ή N ενός άλλου μορίου (το οποίο είναι ενωμένο με Η ή και C).