Μάθημα : Χημεία Προσανατολισμού - Κεφάλαιο 1 - Παρ.1.1 (Γ' μέρος)
Κωδικός : EL657155
Σύγκριση Διαμοριακών Δυνάμεων - Σύγκριση Σημείου Βρασμού Ουσιών.
Συνοψίζοντας, υπενθυμίζεται ότι οι δεσμοί κατά σειρά αυξανόμενης ισχύος έχουν ως εξής:
London < Δίπολο–Δίπολο < Δεσμοί Υδρογόνου < Δίπολο–Ιον < Ιόν – Ιόν (ιοντικός δεσμός)
και ότι ισχυρότεροι δεσμοί συνεπάγονται μεγαλύτερο σημείο βρασμού.
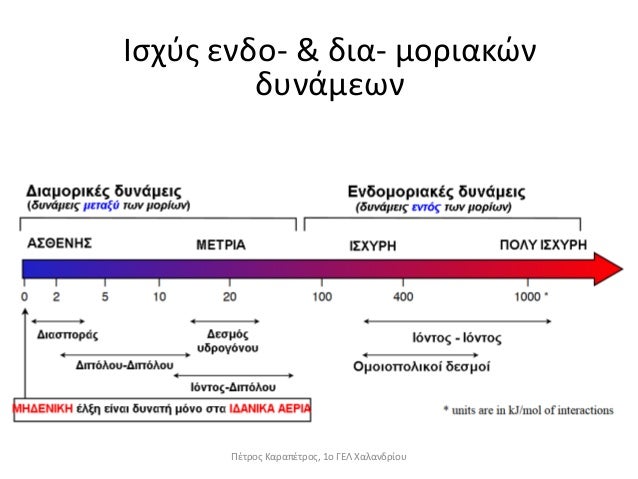
Όπως προαναφέρθηκε εκτός από την ισχύ των δεσμών σημαντικό ρόλο παίζει και το Μοριακό Βάρος της ουσίας, με μεγαλύτερο Μ.Β. να συνεπάγεται μεγαλύτερο Σημείο Βρασμού. Βέβαια όσο μεγαλύτερη είναι η ισχύς των δεσμών τόσο μικρότερη είναι η επίδραση του Μ.Β. με αποτέλεσμα να είναι καθοριστικό στις άπολες ενώσεις.
Χαρακτηριστικό παράδειγμα είναι η σύγκριση των υδραλογόνων HF, HCl, HBr και ΗΙ. Ενώ τα τρια τελευταία είναι περιπτώσεις δυνάμεων διπόλου-διπόλου και το Μοριακό Βάρος είναι αυτό που καθορίζει τη διαφορά στο Σημείο Βρασμού, στο HF λόγω του πολωμένου δεσμού H-F σχηματίζονται δεσμοί Υδρογόνου μεταξύ των μορίων του και είναι αυτοί που καθορίζουν το Σημείο Βρασμού του.
Σε κάθε περίπτωση όταν μας ζητείται να συγκρίνουμε δυο ουσίες ως προς το Σημείο Βρασμού τους, θα πρέπει να αναφερόμαστε και στο είδος των δυνάμεων και στο Μοριακό Βάρος.

Όπως βλέπουμε και από τον παραπάνω πίνακα, η διαφορές στις ενέργειες των διαμοριακών δυνάμεων είναι σημαντικές ώστε να υπερτερούν των άλλων παραγόντων.
Συνοψίζοντας, για την σύγκριση του Σημείου Βρασμού ελέγχουμε κατά σειρά:
1. Είδος διαμοριακών δυνάμεων. Αν είναι ίδιες τότε ελέγχουμε
2. Μοριακό Βάρος. Αν έχουμε άπολες ενώσεις ίδιου ή παρεμφερούς Μοριακού Βάρους τότε ελέγχουμε
3. Σχήμα μορίου.