Μάθημα : Χημεία Προσανατολισμού - Κεφάλαιο 3 (Β' Μέρος)
Κωδικός : EL657228
-
Θεματικές Ενότητες
Θερμοκρασία
Η θερμοκρασία αποτελεί μέτρο της μέσης κινητικής ενέργειας των μορίων. Φυσικά δεν έχουν όλα τα μόρια την ίδια ταχύτητα (άρα και κινητική ενέργεια). Αυτό περιγράφεται στις καμπύλες Maxwell Boltzmann που απεικονίζεται η κατανομή των μορίων με βάση την ενέργεια τους. Η μορφή της καμπύλης διαφέρει ανάλογα με τη θερμοκρασία.
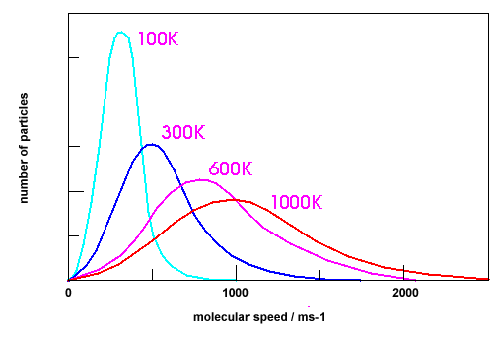
Παρατηρούμε ότι σε μικρές θερμοκρασίες οι πιθανές τιμές της κινητικής ενέργειας είναι μικρότερες κι έτσι έχουμε πολλά μόρια με παρεμφερείς τιμές (μεγάλο ύψος καμπύλης σε χαμηλή ενέργειες). Όσο οι θερμοκρασία μεγαλώνει, τόσο μεγαλώνει και το εύρος τιμών της ενέργειας που μπορεί να έχουν τα μόρια, έτσι έχουμε μεγαλύτερη διασπορά και χαμηλότερες καμπύλες, οι οποίες όμως εκτείνονται σε όλο και μεγαλύτερες τιμές. Το εμβαδόν της επιφάνειας κάτω από την καμπύλη μας δίνει τον αριθμό των μορίων. Όσο μεγαλύτερη είναι η θερμοκρασία, τόσο περισσότερα μόρια έχουν ενέργεια ίση ή μεγαλύτερη της ενέργειας ενεργοποίησης οπότε μπορούν να δώσουν αποτελεσματικές συγκρούσεις.
Κατά συνέπεια αύξηση της ταχύτητας οδηγεί πάντα σε αύξηση της ταχύτητας (εξαίρεση αποτελούν οι ενζυμικά καταλυόμενες αντιδράσεις) και μείωση της θερμοκρασίας συνεπάγεται μείωση της ταχύτητας (ανεξαιρέτως).
Αντίδραση οξείδωσης του Οξαλικού οξέος με Υπερμαγγανικό Κάλιο, σε τρεις διαφορετικές θερμοκρασίες και παρουσία καταλύτη (Mn2+).