Μάθημα : ΧΗΜΕΙΑ Γ' τάξης (Ομάδας προσανατολισμού θετικών σπουδών)
Κωδικός : EL31106
ΧΓΘΤ - ΘΕΟΔΩΡΟΣ ΧΑΡΑΛΑΜΠΗΣ
Η πλατφόρμα σάς ανακατεύθυνε αυτόματα στην αρχική σελίδα για να συνδεθείτε προτού προχωρήσετε σε άλλες ενέργειες. Πιθανόν, να έληξε η σύνοδός σας.
Περιγραφή Μαθήματος

Σκοπός
Η διδασκαλία της Χημείας ως μαθήματος Γενικής Παιδείας αλλά και Κατεύθυνσης -σύμφωνα με το αναλυτικό πρόγραμμα του Υ.ΠΑΙ.Θ - έχει σκοπό:
1. να προσφέρει στο μαθητή γνώσεις σχετικές με έννοιες, θεωρίες, νόμους και αρχές που αφορούν στη Χημεία.
2. να καλλιεργήσει την ικανότητά του να συνδυάζει επιστημονικά δεδομένα, να κάνει υπολογισμούς και να εξάγει συμπεράσματα.
3. να καλλιεργήσει την ικανότητά του να διατυπώνει υποθέσεις και να προσπαθεί να τις επαληθεύσει, χρησιμοποιώντας την επιστημονική μέθοδο.
4. να τον βοηθήσει να εκτελεί πειράματα, να καταγράφει τις μετρήσεις, να ελέγχει την αξιοπιστία τους και να ερμηνεύει τα αποτελέσματα.
5. να εξοικειωθεί ο μαθητής με τη χρήση της «χημικής γλώσσας», για να μεταδίδει πληροφορίες και να υποστηρίζει τα επιχειρήματά του.
6. να κατανοήσει τη συμβολή της Χημείας στη βελτίωση της ποιότητας της ζωής του σύγχρονου ανθρώπου αλλά και τους κινδύνους από την αλόγιστη χρήση της.
7. να συλλέγει πληροφορίες από επιστημονικές πηγές, αξιοποιώντας την τεχνολογία της πληροφορικής.
Εξεταστέα ύλη
Εξεταστέα ύλη πανελλαδικών εξετάσεων 2022 - 2023 για το μάθημα της Χημείας
-
Διδάσκοντες
Θεόδωρος Χαραλάμπης
Χημικός ΠΕ04.02
Προτεινόμενα συγγράμματα
«ΧΗΜΕΙΑ - ΤΕΥΧΟΣ Α'» των Σ.Λιοδάκη, Δ. Γάκη, Δ. Θεοδωρόπουλου, Αν. Κάλλη, Ινστιτούτο Τεχνολογίας Υπολογιστών και Εκδόσεων "ΔΙΟΦΑΝΤΟΣ"
«ΧΗΜΕΙΑ - ΤΕΥΧΟΣ Β'» των Σ.Λιοδάκη, Δ. Γάκη, Δ. Θεοδωρόπουλου, Αν. Κάλλη, Ινστιτούτο Τεχνολογίας Υπολογιστών και Εκδόσεων "ΔΙΟΦΑΝΤΟΣ"
Πηγή : https://en.wikipedia.org/wiki/Bohr_model
Στόχοι του μαθήματος
Στο τέλος της διδακτικής αυτής ενότητας, ο μαθητής θα πρέπει να είναι ικανός :
- Να περιγράφει το ατομικό πρότυπο του Bohr διατυπώνοντας τις δύο συνθήκες του Bohr και να αναφέρει τους περιορισμούς του μοντέλου.
- Να υπολογίζει τη μεταβολή ενεργειακής στάθμης του ηλεκτρονίου στο άτομο του υδρογόνου ή σε υδρογονοειδή άτομα από τη συχνότητα ή το μήκος κύματος του απορροφούμενου/εκπεμπόμενου φωτονίου και αντίστροφα.
Ύλη προς μελέτη :
Τεύχος Β' : σελ. 203 - 205
Ασκήσεις :
(Β) Ερωτήσεις : 1,2,3,4,5,6,7 Ασκήσεις : 24,25,27,28,29
(Φ) Ι1 : 3,4,5 Ι2 : 1,2,3 Ι5 : 1,2
Παρουσίαση μαθήματος :
-------------------------------------------------------
Σύνδεσμοι προσομοιώσεων :
Βιντεοδιάλεξη (Study4Exams) :
Πηγή : https://repository.kallipos.gr
Στόχοι του μαθήματος
Στο τέλος της διδακτικής αυτής ενότητας, ο μαθητής θα πρέπει να είναι ικανός :
- Να αναφέρει τον ορισμό του ατομικού τροχιακού και να το διακρίνει από την τροχιά και το ηλεκτρονιακό νέφος
- Να αναγνωρίζει και να απεικονίζει γραφικά τα τροχιακά s και p.
- Να αναφέρει ποιοι είναι οι κβαντικοί αριθμοί, τι εκφράζει και τι τιμές παίρνει καθένας από αυτούς.
- Να εξηγεί ότι τα ηλεκτρόνια κάθε
-
- στιβάδας έχουν κοινό μόνο τον κύριο κβαντικό αριθμό n,
- υποστιβάδας έχουν κοινούς τους κβαντικούς αριθμούς n και ℓ,
- τροχιακού έχουν κοινούς τρεις κβαντικούς αριθμούς n, ℓ και mℓ.
Ύλη προς μελέτη :
Τεύχος Β' : σελ. 209 - 212
Ασκήσεις :
(Β) Ερωτήσεις : 8,9 Ασκήσεις : 30,31,32,34,35,36,37,38
(Φ) Ι1 : 7,29,31,32,35 Ι3 : 5,18,19 Ι4 : 1,2,3 Ι5 : 3,4,5
Παρουσίαση μαθήματος :
-------------------------------------------------------
Βιντεοδιάλεξη (Study4Exams) :
Πηγή : ebooks.edu.gr
Στόχοι του μαθήματος
Στο τέλος της διδακτικής αυτής ενότητας, ο μαθητής θα πρέπει να είναι ικανός :
- Να διατυπώνει τις αρχές ηλεκτρονιακής δόμησης (aufbau)
- αρχή της ελάχιστης ενέργειας,
- απαγορευτική αρχή του Pauli,
- κανόνας του Hund,
- Να προσδιορίζει την ηλεκτρονική κατανομή τόσο σε επίπεδο υποστιβάδων, όσο και σε επίπεδο τροχιακών
- ενός ατόμου στη θεμελιώδη κατάσταση,
- ενός ατόμου σε διεγερμένη κατάσταση,
- ενός ιόντος,
Ύλη προς μελέτη :
Τεύχος Β' : σελ. 213 - 216
Ασκήσεις :
(Β) Ερωτήσεις : 11,12 Ασκήσεις : 39, 40, 41, 42, 43, 44, 45, 47,74
(Φ) Ι1 : 8,10,11,12,18,19,20,21,22,27,2833,39,41 Ι2 : 7,8,17,29,30,37 Ι3 : 7,10 Ι6 : 1,2 Προβλήματα : 1,2
Παρουσίαση μαθήματος :
-------------------------------------------------------
Βιντεοδιάλεξη (Study4Exams) :
Πηγή : ebooks.edu.gr
Στόχοι του μαθήματος
Στο τέλος της διδακτικής αυτής ενότητας, ο μαθητής θα πρέπει να είναι ικανός :
- Να συνδέει την ηλεκτρονιακή δόμηση των στοιχείων με την κατάταξη τους στον περιοδικό πίνακα.
- Να εξηγεί ποια ηλεκτρόνια αποκαλούνται ηλεκτρόνια σθένους.
- Να προσδιορίζεις τη θέση σε περίοδο και ομάδα κάθε στοιχείου, με δεδομένο τον ατομικό του αριθμό και αντίστροφα.
- Να ταξινομεί τα στοιχεία, ανάλογα με την ηλεκτρονιακή τους δόμηση, στους τομείς s, p, d και f.
- Να περιγράφει την περιοδική μεταβολή που παρατηρείται στις ιδιότητες των στοιχείων της 2ης και 3ης περιόδου (από το μεταλλικό στον αμεταλλικό χαρακτήρα), καθώς και των ενώσεων τους, όπως των οξειδίων και χλωριδίων τους.
- Να αναφέρει τον ορισμό και ορισμένες ιδιότητες των στοιχείων μετάπτωσης, όπως μεταλλικός χαρακτήρας, πολλαπλότητα αριθμού οξείδωσης, σχηματισμός συμπλόκων ιόντων, σχηματισμός έγχρωμων ενώσεων, παραμαγνητικές ιδιότητες και καταλυτική ικανότητα.
- Να εξηγεί τις ακόλουθες ιδιαιτερότητες που παρουσιάζουν στην ηλεκτρονιακή τους δόμηση τα στοιχεία μεταπτώσεως
- η υποστιβάδα 3d αφού πάρει ηλεκτρόνια αποκτά μικρότερη ενέργεια από την 4s
- Τα στοιχεία 24Cr και 29Cu, λόγω της σταθερότητας των δομών d5 και d10 έχουν κατανομή ηλεκτρονίων σθένους που αποκλίνει ελαφρά από την αναμενόμενη σύμφωνα με τις αρχές ηλεκτρονιακής δόμησης.
- Να αποφαίνεται για το αν ένα στοιχείο είναι παραμαγνητικό με βάση την ηλεκτρονιακή του κατανομή.
Ύλη προς μελέτη :
Τεύχος Β' : σελ. 216 - 221
Ασκήσεις :
(Β) Ερωτήσεις : 13,14,15,16,17 Ασκήσεις : 51,52,53,76,78(α)
(Φ) Ι1 : 13,14,15,16,17,26,30,36,38,40 Ι2 : 10,13,32,33,34,40,47 Ι3 : 3,6,8,22 Ι5 : 6 Προβλήματα : 3,4,5
Παρουσίαση μαθήματος :
-------------------------------------------------------
Βιντεοδιάλεξη (Study4Exams) :
 Πηγή : ebooks.edu.gr
Πηγή : ebooks.edu.gr
Στόχοι του μαθήματος
Στο τέλος της διδακτικής αυτής ενότητας, ο μαθητής θα πρέπει να είναι ικανός :
- Να ορίζει την ατομική ακτίνα, να περιγράφει και να εξηγεί πως μεταβάλλεται σε μία περίοδο και σε μία ομάδα του περιοδικού πίνακα.
- Να συγκρίνει το μέγεθος ατόμων και ιόντων.
- Να ορίζει τις ενέργειες 1ου, 2ου κλπ. ιοντισμού, να περιγράφει και να εξηγεί
- ποια σχέση έχουν μεταξύ τους οι τιμές 1ου, 2ου κλπ. ιοντισμού ενός ατόμου,
- πώς μεταβάλλεται η ενέργεια 1ου ιοντισμού σε μία περίοδο και σε μία ομάδα του περιοδικού πίνακα.
- Να συγκρίνει τις ενέργειες ιοντισμού ατόμων και ιόντων.
- Να ορίζει την ηλεκτροθετικότητα και την ηλεκτραρνητικότητα και να περιγράφει πως μεταβάλλονται σε μία περίοδο και σε μία ομάδα του περιοδικού πίνακα.
- Να αναγνωρίζει ότι η ατομική ακτίνα, το πυρηνικό φορτίο και τα ηλεκτρόνια σθένους καθορίζουν, σε μεγάλο βαθμό, τις ιδιότητες του ατόμου ενός στοιχείου.
Ύλη προς μελέτη :
Τεύχος Β' : σελ. 222 - 225
Ασκήσεις :
(Β) Ερωτήσεις : 18,19 Ασκήσεις : 55,56(-δ),58(γ,δ),75,77
(Φ) Ι1 : 23,24,25,37 Ι2 : 9,12,14,15,16,19,20,21,22,23,25,26,27,28,35,36,38,39,41,46,48,49,50 Ι3 : 1,9,14,23 Προβλήματα : 6,7
Παρουσίαση μαθήματος :
-------------------------------------------------------
Βιντεοδιάλεξη (Study4Exams) :
Στόχοι του μαθήματος
Στο τέλος της διδακτικής αυτής ενότητας, ο μαθητής θα πρέπει να είναι ικανός :
- Να αναφέρει τις βασικές αρχές τις θεωρίας του δεσμού σθένους.
- Να εξηγεί τον τρόπο σχηματισμού του σ δεσμού, δίνοντας σχετικό παράδειγμα.
- Να διατυπώνει τις έννοιες μήκος δεσμού και ενέργεια δεσμού.
- Να εξηγεί τον τρόπο σχηματισμού του π δεσμού, δίνοντας σχετικό παράδειγμα.
- Να αναφέρει τις βασικές διαφορές μεταξύ σ και π δεσμού.
Ύλη προς μελέτη :
Τεύχος Β' Κεφ.7ο : σελ.253 - 256
Ασκήσεις :
(Β) Ερωτήσεις : 1,2,3,4 Ασκήσεις : 40
(Φ) Ι2 : 46,55 Ι3 : 12,13,16,24 Ι5 : 7,8
Παρουσίαση μαθήματος
-----------------
Βιντεοδιάλεξη (Από Study4Exams)
Στόχοι του μαθήματος
Στο τέλος της διδακτικής αυτής ενότητας, ο μαθητής θα πρέπει να είναι ικανός :
- Να αναφέρει παραδείγματα ενώσεων, όπως BeH2, BF3 και CH4, στα οποία η θεωρία δεσμού σθένους αδυνατεί να εξηγήσει τους δεσμούς που έχουν, προκειμένου να αναδείξει την ανάγκη εισαγωγής της θεωρίας του υβριδισμού.
- Να περιγράφει τις μορφές υβριδισμού sp, sp2 και sp3 καθορίζοντας τη γεωμετρική τους διάταξη και δίνοντας σχετικά παραδείγματα.
- Να χρησιμοποιεί τη θεωρία του δεσμού σθένους και του υβριδισμού για να εξηγήσει τους δεσμούς και τη γεωμετρία των μορίων BeH2, BF3 και CH4.
- Να περιγράφει με βάση θεωρία του δεσμού σθένους και του υβριδισμού το σχηματισμό του απλού δεσμού C - C, του διπλού δεσμού C = C και του τριπλού δεσμού C ≡ C, να δίνει τις γωνίες μεταξύ των δεσμών, καθώς και το σχήμα του μορίου σε κάθε περίπτωση.
- Να αναφέρει τους σ και π δεσμούς, τα επικαλυπτόμενα ατομικά τροχιακά, τις γωνίες μεταξύ των δεσμών, καθώς και το σχήμα του μορίου για απλές οργανικές ενώσεις με ανθρακική αλυσίδα μέχρι 4 άνθρακες.
Ύλη προς μελέτη :
Τεύχος Β' Κεφ.7ο : σελ.253 - 256
Ασκήσεις :
(Β) Ερωτήσεις : 5 Ασκήσεις : 42,43,44,45,46,47,48
(Φ) Ι2 : 43,44,45,47,48,49,50,51,52,53,54,56 Ι3 : 17,20,21,25 Ι5 : 9,10
Παρουσίαση μαθήματος
-----------------
Βιντεοδιάλεξη (Από Study4Exams)
Πηγή : ebooks.edu.gr
Στόχοι του μαθήματος
Στο τέλος της διδακτικής αυτής ενότητας, ο μαθητής θα πρέπει να είναι ικανός :
- Να αναφέρει τι είναι διπολική ροπή και να τη χρησιμοποιεί για να περιγράψει την πολικότητα ενός δεσμού.
- Να προβλέπει τη συνολική διπολική ροπή ενός μορίου αν γνωρίζει τις διπολικές ροπές των δεσμών και το σχήμα του μορίου, σε πολύ απλές περιπτώσεις.
- Να περιγράφει τις δυνάμεις διπόλου-διπόλου και να συνδέει την ισχύ τους με τη διπολική ροπή των μορίων.
- Να περιγράφει τις δυνάμεις διασποράς (London) και να συνδέει την ισχύ τους με τη σχετική μοριακή μάζα και το σχήμα των μορίων.
- Να περιγράφει το δεσμό υδρογόνου και να εξηγεί τις συνέπειές του στη συμπεριφορά του νερού καθώς και άλλων ουσιών.
- Να περιγράφει τις δυνάμεις ιόντος-διπόλου και να αναφέρει από ποιους παράγοντες επηρεάζονται.
- Να συγκρίνει την ισχύ ενδομοριακών και διαμοριακών δεσμών διαφορετικών ουσιών.
- Να χρησιμοποιεί τα διάφορα είδη διαμοριακών δυνάμεων για να εξηγήσει διαφορές στις τιμές ιδιοτήτων ουσιών όπως: Σημείο βρασμού, διαλυτότητα των ενώσεων σε πολικούς και μη πολικούς διαλύτες.
Ύλη προς μελέτη :
Τεύχος Α' Κεφ.1ο : σελ.13 - 19
Ασκήσεις :
(Β) Ερωτήσεις : 1,2,3,4,5 Ασκήσεις : 16(-δ),17,18,19,20,21,22,23
(Φ) Ι1 : 1,2,3,4,5,6,7,8,9,10,11,12,13,14,15,16,17,18,19,20,23,24,25,26 Ι2 : 1,2,3,4 Ι3 : 1,2,3,4,5 Ι4 : 1,2,4,5,6 Ι5 : 1,2,3,4,5,6,7,8,9,10,11,19,20 Ι6 : 1,3 Ι7 : 1,2,3,4,5,7,10
Παρουσίαση μαθήματος
-----------------
Βιντεοδιάλεξη (Από Study4Exams)
-----------------
(Εκτός ύλης) Υπολογισμός μέγιστου αριθμού δεσμών Η ανά μόριο μίας ουσίας σε μία ορισμένη ποσότητα της ουσίας
Πηγή : ebooks.edu.gr
Στόχοι του μαθήματος
Στο τέλος της διδακτικής αυτής ενότητας, ο μαθητής θα πρέπει να είναι ικανός :
- Να εξηγεί τι είναι τα μοριακά και τι τα ηλεκτρολυτικά ή ιοντικά διαλύματα.
- Να αναφέρει τι ονομάζουμε προσθετικές ιδιότητες διαλυμάτων.
- Να περιγράφει το φαινόμενο της ώσμωσης και να διατυπώνει τον ορισμό της.
- Να διατυπώνει τον ορισμό της ωσμωτικής πίεσης.
- Να υπολογίζει την ωσμωτική πίεση διαλύματος με βάση το σχετικό νόμο σε αραιά μοριακά και σε αραιά ιοντικά διαλύματα.
- Να εξηγεί τους όρους υπερτονικό, ισοτονικό και υπερτονικό διάλυμα και να δίνει σχετικά παραδείγματα.
- Να προσδιορίζει τη σχετική μοριακή μάζα μιας διαλυμένης ουσίας με βάση την ωσμωτική πίεση.
- Να αναφέρει για τη βιολογική σημασία της ώσμωσης – ωσμωτικής πίεσης, και να εξηγεί τη συμπεριφορά των ερυθρών αιμοσφαιρίων σε ισοτονικά, υπερτονικά και υποτονικά διαλύματα.
Ύλη προς μελέτη :
Τεύχος Α' Κεφ.1ο : σελ. 33 - 38 (εκτός από την ενότητα : Αντίστροφη ώσμωση)
Ασκήσεις :
(Β) Ερωτήσεις : 8,13,15 Ασκήσεις : 35,57,58,59,60,61,62,63,64,65,66,67,68,69,70
(Φ) Ι1 : 21,22 Ι3 : 5 Ι4 : 7,8,9,10,11,12 Ι5 : 13,14,15,16,17,18,21,22,23,24,25,27 Ι6 : 2,4,8 Προβλήματα : 1,2,3,4,5,6,7,8,9,10
Παρουσίαση μαθήματος
-----------------
Βιντεοδιάλεξη (Από Study4Exams)
-----------------
Πηγή : ebooks.edu.gr
Στόχοι του μαθήματος
Στο τέλος της διδακτικής αυτής ενότητας, ο μαθητής θα πρέπει να είναι ικανός :
- Να αναφέρει το αντικείμενο μελέτης της χημικής θερμοδυναμικής και της θερμοχημείας.
- Να εξηγεί πότε μία αντίδραση είναι ενδόθερμη και πότε εξώθερμη.
- Να αναφέρει ορισμένα χαρακτηριστικά της ενθαλπίας.
- Να δίνει τον ορισμό της μεταβολής ενθαλπίας αντίδρασης (ΔH).
- Να συνδέει το εκλυόμενο ή απορροφούμενο ποσό θερμότητας μιας αντίδρασης με την μεταβολή της ενθαλπίας (ΔH).
- Να διακρίνει τη διαφορά στο πρόσημο μεταξύ των μεγεθών ΔH και Q.
- Να εξάγει συμπεράσματα από τα ενεργειακά διαγράμματα μετατροπής των αντιδρώντων σε προϊόντα και να μπορεί να σχεδιάσει αντίστοιχα διαγράμματα.
- Να εξηγεί από ποιους παράγοντες εξαρτάται η τιμή της μεταβολής ενθαλπίας μιας αντίδρασης.
- Να αναγνωρίζει ότι ο τρόπο αναγραφής της χημικής εξίσωσης επηρεάζει την τιμή της μεταβολής ενθαλπίας που αναγράφεται στη θερμοχημική εξίσωση.
- Να αναφέρει ποια είναι η πρότυπη κατάσταση στη θερμοχημεία.
- Να ορίζει τι είναι πρότυπη ενθαλπία αντίδρασης (ΔΗο), σχηματισμού (ΔΗfο), καύσης (ΔΗcο) και εξουδετέρωσης (ΔΗnο).
- Να επιλύει ασκήσεις που συνδέουν τις ποσότητες των συστατικών μιας αντίδρασης με το ποσό της εκλυόμενης ή απορροφούμενης θερμότητας και αντίστροφα.
- Να διατυπώνει τους νόμους της θερμοχημείας (Lavoisier-Laplace & Hess) και να επιλύει προβλήματα που στηρίζονται στους νόμους αυτούς.
Ύλη προς μελέτη :
Από το σχολικό βιβλίο : Τεύχος Β' Κεφ.2ο : σελ.43 - 50 & 54 - 57
Ασκήσεις :
(Β) Ερωτήσεις : 1 -10 (εκτός 7 & 8) Ασκήσεις : 11, 12(-γ), 13, 14, 15, 16, 17, 18, 19, 20, 22, 29, 30, 31, 32, 33, 35, 36, 37, 40, 41
(Φυλλάδιο)
Παρουσίαση μαθήματος
-----------------
Βιντεοδιάλεξη (Από Study4Exams)
http://www.media.pearson.com.au/schools/cw/au_sch_irwin_cc1_2/int/ch19/ratesOfChange/f1/1301.html
Στόχοι του μαθήματος
Στο τέλος της διδακτικής αυτής ενότητας, ο μαθητής θα πρέπει να είναι ικανός :
- Να αναφέρει το αντικείμενο μελέτης της χημικής κινητικής.
- Να απαριθμεί λόγους που δείχνουν γιατί είναι σημαντικό να επηρεάζουμε την ταχύτητα των χημικών φαινομένων.
- Να εξηγεί τις βασικές προϋποθέσεις για να είναι αποτελεσματική μια σύγκρουση μεταξύ αντιδρώντων μορίων.
- Να περιγράφει τη θεωρία της μεταβατικής κατάστασης.
- Να εξηγεί τι είναι η ενέργεια ενεργοποίησης και τι το ενεργοποιημένο σύμπλοκο.
- Να αξιοποιεί τις τιμές της ενέργειας ενεργοποίησης διαφορετικών αντιδράσεων για να συγκρίνει τις ταχύτητές τους.
- Να αξιοποιεί δεδομένα από διαγράμματα που δείχνουν τα ενεργειακά χαρακτηριστικά της μετατροπής των αντιδρώντων σε προϊόντα, συμπεριλαμβανόμενου του ενεργοποιημένου συμπλόκου, και να μπορεί να εξάγει συμπεράσματα από αυτά.
- Να ορίζει το μέσο ρυθμό κατανάλωσης συγκέντρωσης αντιδρώντος (ή ταχύτητα κατανάλωσης αντιδρώντος) και το μέσο ρυθμό παραγωγής συγκέντρωσης προϊόντος (ή ταχύτητα παραγωγής προϊόντος).
- Να διακρίνει τη διαφορά στο πρόσημο μεταξύ μέσου ρυθμού μεταβολής συγκέντρωσης αντιδρώντος και μέσου ρυθμού κατανάλωσης συγκέντρωσης αντιδρώντος.
- Να εξηγεί τη σχέση μεταξύ ρυθμών μεταβολής συστατικών της αντίδρασης και των συντελεστών που αυτά φέρουν στη χημική εξίσωση της αντίδρασης.
- Να ορίζει τη μέση ταχύτητα αντίδρασης και να δίνει τις δυνατές εκφράσεις που μπορεί να έχει η μέση ταχύτητα ανάλογα με το σώμα του οποίου προσδιορίζεται η μεταβολή της συγκέντρωσης.
- Να εξηγεί γιατί η ταχύτητα των περισσότερων χημικών αντιδράσεων ελαττώνεται με φθίνοντα ρυθμό.
- Να διακρίνει την ταχύτητα μιας αντίδρασης από το ρυθμό (ή ταχύτητα) κατανάλωσης αντιδρώντος, ή σχηματισμού προϊόντος.
- Να ορίζει τη στιγμιαία ταχύτητα αντίδρασης και να δίνει τις δυνατές εκφράσεις που μπορεί να έχει η στιγμιαία ταχύτητα ανάλογα με το σώμα του οποίου προσδιορίζεται η μεταβολή της συγκέντρωσης.
- Να εξηγεί τι είναι η καμπύλη αντίδρασης και να σχεδιάζει, ποιοτικά, διάγραμμα καμπύλης αντίδρασης από δεδομένα.
- Να αξιοποιεί δεδομένα από διαγράμματα καμπυλών αντίδρασης και να μπορεί να εξάγει συμπεράσματα από αυτά σχετικά με τις μεταβολές συγκεντρώσεων των υπολοίπων συστατικών της αντίδρασης.
- Να αξιοποιεί πειραματικά δεδομένα για τον υπολογισμό της ταχύτητας μιας αντίδρασης.
- Να επιλύει ασκήσεις και προβλήματα που χρειάζονται στοιχειομετρικούς υπολογισμούς για τον προσδιορισμό της μέσης ταχύτητα της αντίδρασης, της μέσης ταχύτητας κατανάλωσης αντιδρώντος και της μέσης ταχύτητας παραγωγής προϊόντος.
- Να επιλύει ασκήσεις και προβλήματα προσδιορισμού στοιχειομετρικών παραμέτρων αξιοποιώντας δεδομένα σχετικά με τη μέση ταχύτητα της αντίδρασης ή τη μέση ταχύτητα κατανάλωσης αντιδρώντος ή τη μέση ταχύτητας παραγωγής προϊόντος.
Ύλη προς μελέτη :
Από το σχολικό βιβλίο : Τεύχος Α' Κεφ.3ο : σελ.85 - 89
Ασκήσεις :
Από σχολικό εγχειρίδιο : σελ.105-106 22, 23, 24, 25, 26, 28, 29, 30, 31, 32, 33 (στις δύο τελευταίες να υπολογιστούν επιπλέον οι ρυθμοί κατανάλωσης και σχηματισμού αντιδρώντων και προϊόντων αντίστοιχα, καθώς και να σχεδιαστούν οι καμπύλες αντίδρασης αυτών)
Από το φυλλάδιο : ΙΙ1 : 2, 3, 5, 6, 9, 10, 12, 13, 14, 15, 19, 21 ΙΙ2 : 1, 2, 3, 4, 6, 7 ΙΙ3 : 1, 2 ΙΙ4 : 1(-Δ), 2, 3 ΙΙ5 : 1
Προβλήματα : 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 11
Εργαστηριακές ασκήσεις :
2η Εργαστηριακή άσκηση (Φυλλάδιο)
Παρουσίαση μαθήματος
-----------------
Βιντεοδιάλεξη (Από Study4Exams)
Γενικά για τη χημική κινητική - Μέση ταχύτητα - Στιγμιαία ταχύτητα - Καμπύλες αντίδρασης
http://ebooks.edu.gr/ebooks/
Στόχοι του μαθήματος
Στο τέλος της διδακτικής αυτής ενότητας, ο μαθητής θα πρέπει να είναι ικανός :
- Να αναφέρει τους παράγοντες που επηρεάζουν την ταχύτητα της αντίδρασης.
- Να ερμηνεύει την επίδραση της συγκέντρωσης στην ταχύτητα της αντίδρασης.
- Να εξηγεί πότε και πώς η μεταβολή της πίεσης επηρεάζει την ταχύτητα της αντίδρασης.
- Να εξηγεί πότε και πώς η μεταβολή της επιφάνειας στερεού αντιδρώντος επηρεάζει την ταχύτητα της αντίδρασης
- Να εξηγεί τον τρόπο με το οποίο η μεταβολή της θερμοκρασίας επηρεάζει την ταχύτητα της αντίδρασης.
- Να μπορεί να συσχετίσει το διάγραμμα ενεργειακής κατανομής μορίων (Maxwell – Boltzmann) με τις μεταβολές θερμοκρασίας, την ενέργεια του ενεργοποιημένου συμπλόκου και την μεταβολή ταχύτητας της αντίδρασης.
- Να αναφέρει με ποιόν τρόπο οι ακτινοβολίες επιταχύνουν ορισμένες αντιδράσεις.
Ύλη προς μελέτη :
Από το σχολικό βιβλίο : Τεύχος Α' Κεφ.3ο : σελ.90 - 91
Ασκήσεις :
Από σχολικό εγχειρίδιο : σελ.107-108 & 110 - 111 34, 35, 38(α,β), 40(α,ε), 52, 53
Από το φυλλάδιο : ΙΙ1 : 16, 17, 20 ΙΙ2 : 8, 9, 13, 14, 15 ΙΙ3 : 1, 2 ΙΙ5 : 2 ΙΙ6 : 2, 5, 6
Εργαστηριακές ασκήσεις :
3η Εργαστηριακή άσκηση (Φυλλάδιο)
Παρουσίαση μαθήματος
-----------------
Βιντεοδιάλεξη (Από Study4Exams)
Παράγοντες που επηρεάζουν την ταχύτητα της αντίδρασης Μέρος 1ο
https://sites.google.com/site/xhmeiablyk/news/chemike-kinetike/2-paragontes-pou-epereazoun-tachyteta/katalyse
Στόχοι του μαθήματος :
Στο τέλος της διδακτικής αυτής ενότητας, ο μαθητής θα πρέπει να είναι ικανός :
- Να αναφέρει τον ορισμό του καταλύτη, να δίνει παραδείγματα καταλυόμενων αντιδράσεων, να εξηγεί τη σημασία των καταλυτών και τους περιορισμούς τους.
- Να διακρίνει τα διάφορα είδη κατάλυσης.
- Να αναφέρει τα ιδιαίτερα χαρακτηριστικά των ενζύμων και να διατυπώνει τα βασικά πλεονεκτήματά τους, καθώς και τους περιορισμούς τους.
- Να συνδέει το ρόλο του καταλύτη με την αλλαγή του μηχανισμού με τον οποίο λαμβάνει χώρα η αντίδραση, δηλαδή μέσω μιας μεταβατικής κατάστασης χαμηλότερης ενέργειας ενεργοποίησης.
- Να εξηγεί τη δράση των καταλυτών με βάση τη θεωρία των ενδιάμεσων προϊόντων και τη θεωρία προσρόφησης
- Να αναφέρει χαρακτηριστικά παραδείγματα εφαρμογών της κατάλυσης στη χημική βιομηχανία και βιοχημεία.
Ύλη προς μελέτη :
Τεύχος Α' : σελ. 93 - 95
Ασκήσεις :
Ερωτήσεις βιβλίου : 12, 13, 14, 15, 16
Ασκήσεις βιβλίου : 38(γ,δ), 39, 55
Βιντεοδιάλεξη (Study4Exams) :
Πηγή : ebooks.edu.gr
Νόμος ταχύτητας - Μηχανισμός αντίδρασης
Στόχοι του μαθήματος :
Στο τέλος της διδακτικής αυτής ενότητας, ο μαθητής θα πρέπει να είναι ικανός :
- Να εξηγεί τι ονομάζουμε μηχανισμό αντίδρασης.
- Να διακρίνει πότε μια αντίδραση χαρακτηρίζεται ως απλή και πότε ως πολύπλοκη.
- Να εκφράζει τη γενική μορφή του νόμου ταχύτητας μιας αντίδρασης από τη χημική της εξίσωση αυτής.
- Να προσδιορίζει την τάξη κάθε αντιδρώντος καθώς και η συνολική τάξη της αντίδρασης από τον νόμο ταχύτητας.
- Να διατυπώνει τον ορισμό της σταθεράς της ταχύτητας και να αναφέρει τους παράγοντες που την επηρεάζουν.
- Να εξάγει τον νόμο της ταχύτητας μιας αντίδρασης με βάση πειραματικά δεδομένα.
- Να διατυπώνει έναν πιθανό μηχανισμό για μια αντίδραση, όταν δίνεται ο νόμος ταχύτητας αυτής. Επίσης, αν γνωρίζει το αργό στάδιο του μηχανισμού μιας αντίδρασης να μπορεί να γράψει το νόμο ταχύτητας αυτής.
Ύλη προς μελέτη :
Τεύχος Α' Κεφ.1ο : σελ.96 - 98
Ασκήσεις :
Ερωτήσεις βιβλίου : 17, 18, 19, 20, 21
Ασκήσεις βιβλίου : 24, 36, 37, 40(β,γ,δ), 41, 43, 44 - 51, 56
Βιντεοδιάλεξη (Από Study4Exams)
-----------------
Πηγή : ebooks.edu.gr
Στόχοι του μαθήματος
Στο τέλος της διδακτικής αυτής ενότητας, ο μαθητής θα πρέπει να είναι ικανός :
- Να περιγράφει τη βασική διαφορά μεταξύ δυναμικής και στατικής ισορροπίας.
- Να διατυπώνει τον ορισμό των αμφίδρομων αντιδράσεων και της χημικής ισορροπίας.
- Να εξηγεί τον τρόπο με τον οποίο μεταβάλλονται οι ταχύτητες των δύο αντίθετων αντιδράσεων για να φθάσει το σύστημα σε κατάσταση χημικής ισορροπίας.
- Να ερμηνεύει διαγράμματα συγκέντρωσης – χρόνου και ταχύτητας – χρόνου σε αμφίδρομες αντιδράσεις.
- Να ταξινομεί τις χημικές ισορροπίες σε ομογενείς και ετερογενείς, δίνοντας χαρακτηριστικά παραδείγματα σε κάθε περίπτωση.
Ύλη προς μελέτη :
Από το σχολικό βιβλίο : Τεύχος B' Κεφ.4ο : σελ.103 - 106
Ασκήσεις για επόμενο μάθημα :
Από σχολικό εγχειρίδιο : σελ.124 - 125 Ερ.: 1,2,3 Ασκ.: 10, 11, 12, 13, 14, 15(-β)
Από το φυλλάδιο : ΙΙ1 : 1,2,3,4,6,8,9 ΙΙ5 : 1, 2
Παρουσίαση μαθήματος
-----------------
Βιντεοδιάλεξη (Από Study4Exams)
 Σταθερά Χημικής Ισορροπίας
Σταθερά Χημικής Ισορροπίας
Παρατηρήσεις για την Kc
Πηλίκο αντίδρασης
Βιβλίο : Τεύχος Α' σελ.125 - 127 (εκτός ύλης είναι οι παράγραφοι : Κινητική απόδειξη του νόμου χημικής ισορροπίας, Σταθερά χημικής ισορροπίας Κp - Σχέση που συνδέει την Kp με την Κc)
Παρατηρήσεις : 1)Να λάβετε υπόψη σας τις παρατηρήσεις στο περιθώριο των σελίδων 126 και 128
2) Για να παρακολουθήσετε την παρουσίαση θα πρέπει να την κατεβάσετε στον Η/Υ σας και να την ανοίξετε με το office
Ασκήσεις για το αυριανό μάθημα --> από το βιβλίο Παραδείγματα 4.4 και 4.5 με τις εφαρμογές τους, σελ.141 (27), σελ.142 (28) (33) (36)
--> από το φυλλάδιο ΙΙ3 (3, 4, 5, 6, 8) ΙΙ5 (5, 6, 7, 8)
Πηγή : ebooks.edu.gr
Στόχοι του μαθήματος
Στο τέλος της διδακτικής αυτής ενότητας, ο μαθητής θα πρέπει να είναι ικανός :
- Να διακρίνει τις χημικές ενώσεις σε ηλεκτρολύτες και μη ηλεκτρολύτες.
- Να περιγράφει το μηχανισμό της διάλυσης - διάστασης στο νερό μιας ιοντικής ένωσης και να αναφέρει ότι η διάσταση είναι πάντα ποσοτική.
- Να περιγράφει την αντίδραση ιοντισμού στο νερό μιας μοριακής (ομοιοπολικής) ένωσης.
- Να διακρίνει τις έννοιες διάσταση και ιοντισμός.
Ύλη προς μελέτη :
Από το σχολικό βιβλίο : Τεύχος Β' Κεφ.5ο : σελ.137 - 138
Ασκήσεις για επόμενο μάθημα :
-----------------
Παρουσίαση μαθήματος
Βιντεοδιάλεξη (Από Study4Exams)
Στόχοι του μαθήματος
Στο τέλος της διδακτικής αυτής ενότητας, ο μαθητής θα πρέπει να είναι ικανός :
- Να αναφέρουν τη θεωρία του Arrhenius ως την πρώτη θεωρία για τα οξέα και τις βάσεις.
- Να αναφέρουν ότι η θεωρία του Arrhenius περιορίζεται μόνο σε υδατικά διαλύματα.
- Να εξηγούν την αναγκαιότητα δημιουργίας μιας νέας θεωρίας που να καλύπτει ευρύτερα τις έννοιες οξύ ή βάση
- Να διατυπώνουν τον ορισμό των οξέων και των βάσεων κατά Brönsted-Lowry.
- Να εντοπίζουν σε μια χημική αντίδραση το οξύ και τη βάση σύμφωνα με τον ορισμό κατά Brönsted–Lowry και να αιτιολογούν τις επιλογές τους
- Να ορίζουν ποιες ουσίες ονομάζονται αμφολύτες.
- Να εξηγούν τις έννοιες του συζυγούς οξέος και της συζυγούς βάσης.
- Να αναγνωρίζουν σε μια χημική εξίσωση ποια είναι τα συζυγή ζεύγη οξέων –βάσεων
- Να γράφουν τη συζυγή βάση ενός οξέος και το συζυγές οξύ μιας βάση
- Να προβλέπουν την ισχύ ενός οξέος ή μιας βάσης, όταν γνωρίζουν την ισχύ της συζυγούς του βάσης ή του οξέος
Ύλη προς μελέτη :
Τεύχος Β' : σελ. 139 - 141
Ασκήσεις :
Παρουσίαση μαθήματος :
Βιντεοδιάλεξη (Study4Exams) :
Στόχοι του μαθήματος
Στο τέλος της διδακτικής αυτής ενότητας, ο μαθητής θα πρέπει να είναι ικανός :
- Να κατονομάζει τα ισχυρά οξέα και τις ισχυρές βάσεις.
- Να διακρίνει τα οξέα και τις βάσεις σε μονοπρωτικά/ές, διπρωτικά/ές και τριπρωτικά/ές.
- Να γράφει τις χημικές εξισώσεις διάστασης/ιοντισμού των ηλεκτρολυτών στο νερό.
- Να εξηγει σε επίπεδο δεσμού H - X ενός οξέος, από ποιούς παράγοντες καθορίζεται η ισχύς του.
- Να περιγράφει πως μεταβάλλεται η ισχύς των οξέων (ή βάσεων) που σχηματίζουν i τα στοιχεία μιας περιόδου και ii. τα στοιχεία μιας ομάδας.
- Να ορίζει το επαγωγικό φαινόμενο και να αναφέρει τα είδη του (-Ι και +Ι επαγωγικό φαινόμενο)
- Να ερμηνεύει τη διαφορά στην ισχύ δύο ηλεκτρολυτών ανάλογα με το είδος του επαγωγικού φαινομένου που παρουσιάζουν γειτονικά στο δεσμό Ο-Η άτομα ή ομάδες ατόμων.
Ύλη προς μελέτη :
Από το σχολικό βιβλίο : Τεύχος Β' Κεφ.5ο : σελ.142 - 143
Βοηθητικό υλικό : Ισχύς και μοριακή δομή
Ασκήσεις για επόμενο μάθημα :
-----------------
Παρουσίαση μαθήματος
Βιντεοδιάλεξη (Από Study4Exams)
Πηγή : ebooks.edu.gr
Στόχοι του μαθήματος
Στο τέλος της διδακτικής αυτής ενότητας, ο μαθητής θα πρέπει να είναι ικανός :
- Να ορίζει το βαθμό ιοντισμού και να αναφέρει τους παράγοντες από τους οποίους αυτός εξαρτάται.
- Να αναφέρει το κριτήριο βάσει του οποίου ένα οξύ ή μία βάση χαρακτηρίζεται ως ισχυρό/ή και ασθενές/ής.
- Να περιγράφει τον αυτοϊοντισμό του νερού, γράφοντας τη σχετική χημική εξίσωση.
- Να ορίζει τη σταθερά ιοντισμού του νερού Kw και να εξηγεί πώς μεταβάλλεται με τη θερμοκρασία.
- Να ορίζει τι είναι pH και τι pOH και να γράφει τη μεταξύ τους σχέση.
- Να συνδέει τη σταθερά ιοντισμού του νερού Kw με την έννοια και το πεδίο ορισμού του pH.
- Να ταξινομεί τα διαλύματα σε όξινα, βασικά και ουδέτερα με βάση την τιμή του pH τους.
Ύλη προς μελέτη :
Από το σχολικό βιβλίο : Τεύχος Β' Κεφ.5ο : σελ.137 - 138
Ασκήσεις για επόμενο μάθημα :
Θεωρητικές ασκήσεις στην κλίμακα pH
Παρουσίαση μαθήματος
-----------------
Βιντεοδιάλεξη (Από Study4Exams)
Ιοντισμός οξέων, βάσεων και νερού - Κλίμακα pH
Πηγή : Dreamtimes.com
Στόχοι του μαθήματος
Στο τέλος της διδακτικής αυτής ενότητας, ο μαθητής θα πρέπει να είναι ικανός :
- Να υπολογίζει την τιμή του pH διαλύματος ισχυρού οξέος ή βάσης όταν δίνεται η συγκέντρωση του και το αντίστροφο κάνοντας, αν χρειάζεται, τους απαραίτητους υπολογισμούς στις περιπτώσεις αραίωσης ή συμπύκνωσης ή ανάμιξης διαλυμάτων του ισχυρού οξέος ή βάσης
Ύλη προς μελέτη :
Από το σχολικό βιβλίο : Τεύχος Β' Κεφ.5ο : σελ.148 - 150
Ασκήσεις για επόμενο μάθημα :
---------------------
Παρουσίαση μαθήματος
-----------------
Βιντεοδιάλεξη (Από Study4Exams)
Στόχοι του μαθήματος
Στο τέλος της διδακτικής αυτής ενότητας, ο μαθητής θα πρέπει να είναι ικανός :
- Να γράφει τις σχέσεις που ορίζουν τις σταθερές ιοντισμού ασθενών οξέων Ka και ασθενών βάσεων Kb και να τις εφαρμόζει.
- Να αποδεικνύει τη σχέση Ka · Kb = Kw για συζυγές ζεύγος οξέος βάσης και να την εφαρμόζει.
- Να διατάσσει οξέα και βάσεις κατά σειρά ισχύος μέσω των Ka/pKa και των Kb/pKb , αντίστοιχα.
- Να εξηγεί προς τα πού είναι μετατοπισμένη μια ισορροπία οξέος-βάσης.
Ύλη προς μελέτη :
Από το σχολικό βιβλίο : Τεύχος Β' Κεφ.5ο : σελ.151 - 154
Ασκήσεις για επόμενο μάθημα :
---------------------
Παρουσίαση μαθήματος
Υδατικά διαλύματα ασθενών οξέων & βάσεων
Βιντεοδιάλεξη (Από Study4Exams)
Υδατικά διαλύματα ασθενών οξέων & βάσεων - Σταθερά ιοντισμού Κa & Kb
Στόχοι του μαθήματος
Στο τέλος της διδακτικής αυτής ενότητας, ο μαθητής θα πρέπει να είναι ικανός :
- Να ορίζει την επίδραση κοινού ιόντος.
- Να εξηγεί το αποτέλεσμα της επίδρασης κοινού ιόντος στον ιοντισμό,
- ασθενούς οξέος με επίδραση ισχυρού οξέος ή με επίδραση συζυγούς βάσης,
- ασθενούς βάσης με επίδραση ισχυρής βάσης ή με επίδραση συζυγούς οξέος.
- Να υπολογίζει τη συγκέντρωση κάθε ιόντος σε διάλυμα που περιέχει ένα ασθενή και ένα ισχυρό ηλεκτρολύτη, οι οποίοι έχουν κοινό ιόν, από κατάλληλα δεδομένα.
- Να υπολογίζει τη συγκέντρωση κάθε ιόντος σε διάλυμα που περιέχει δύο ασθενή οξέα ή δύο ασθενείς βάσεις, από κατάλληλα δεδομένα.
Ύλη προς μελέτη :
Από το σχολικό βιβλίο : Τεύχος Β' Κεφ.5ο : σελ.155 - 158
Ασκήσεις για επόμενο μάθημα :
------------------------
Φυλλάδιο
Βιντεοδιάλεξη (Από Study4Exams)
Στόχοι του μαθήματος
Στο τέλος της διδακτικής αυτής ενότητας, ο μαθητής θα πρέπει να είναι ικανός :
- Να εξηγεί αν ένα άλας θα δημιουργήσει όξινο ή βασικό ή ουδέτερο διάλυμα όταν διαλυθεί στο νερό
- Να γράφει τις σχετικές εξισώσεις που να δικαιολογούν τον χαρακτηρισμό αυτόν
- Να προσδιορίζει το pH των διαλυμάτων αλάτων που έχει προέλθει από εξουδετέρωση 1) ισχυρού οξέος από ισχυρή βάση, 2) ισχυρού οξέος από ασθενή βάση & 3) ασθενούς οξέος από ισχυρή βάση
Ύλη προς μελέτη :
Από το σχολικό βιβλίο : Τεύχος Β' Κεφ.5ο : σελ.154 - 155
Ασκήσεις για επόμενο μάθημα :
Παραδείγματα 5.10 (σελ.154) & 5.11 (σελ.155) και τις εφαρμογές τους
Από φυλλάδιο 5 του ΚΕΕ : σελ.61 τις 31, 33 / σελ.62 τις 35, 36 / σελ.67 τις 9, 10 / σελ.74 την 16 / σελ.79 την 43 / σελ.81 την 22
Παρουσίαση μαθήματος
-------------------------
Βιντεοδιάλεξη (Από Study4Exams)
Πηγή : ebooks.edu.gr
Στόχοι του μαθήματος
Στο τέλος της διδακτικής αυτής ενότητας, ο μαθητής θα πρέπει να είναι ικανός :
- Να διατυπώνει τον ορισμό του ρυθμιστικού διαλύματος, επισημαίνοντας ότι περιέχουν ένα συζυγές ζεύγος ασθενούς οξέος - βάσεως σε παραπλήσιες συγκεντρώσεις.
- Να αναγνωρίζει πότε ένα διάλυμα είναι ρυθμιστικό.
- Να αναφέρει τους τρόπους παρασκευής των ρυθμιστικών διαλυμάτων.
- Να εξηγεί το μηχανισμό δράσης των ρυθμιστικών διαλυμάτων.
- Να αναφέρει τη χρησιμότητα των ρυθμιστικών διαλυμάτων στη καθημερινή ζωή, δίνοντας σχετικά παραδείγματα.
- Να συγκρίνει δυο ρυθμιστικά διαλύματα ως προς τη ρυθμιστική τους ικανότητα.
- Να αποδεικνύει τις σχέσεις των Henderson και Hasselbalch και να τις χρησιμοποιεί για τον υπολογισμό διαφόρων παραμέτρων του ρυθμιστικού διαλύματος, από κατάλληλα δεδομένα.
- Να υπολογίζει διάφορες παραμέτρους ρυθμιστικού διαλύματος στο οποίο προστίθενται μικρές αλλά υπολογίσιμες ποσότητες ισχυρού οξέος ή βάσεως ή γίνεται αραίωση, από κατάλληλα δεδομένα.
Ύλη προς μελέτη :
Τεύχος Β' : σελ. 159 - 164
Ασκήσεις :
.................................
Επιπλέον υλικό
Παρουσίαση μαθήματος :
.......................................
Βιντεοδιάλεξη (Study4Exams) :
Πηγή : ebook.edu.gr
Στόχοι του μαθήματος
Στο τέλος της διδακτικής αυτής ενότητας, ο μαθητής θα πρέπει να είναι ικανός :
- Να ορίζει τους ηλεκτρολυτικούς ή πρωτολυτικούς δείκτες.
- Να γράφει την εξίσωση ιοντισμού ενός δείκτη της μορφής ΗΔ και να εξηγεί την θεωρητική περιοχή αλλαγής χρώματος του δείκτη, όταν είναι γνωστή η KaΗΔ.
- Να αναφέρει τις χρήσεις των δεικτών.
- Να υπολογίζει λόγο
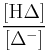 και να εκτιμά το χρώμα του διαλύματος στο οποίο προστίθεται μικρή ποσότητα του δείκτη.
και να εκτιμά το χρώμα του διαλύματος στο οποίο προστίθεται μικρή ποσότητα του δείκτη.
Ύλη προς μελέτη :
Από το σχολικό βιβλίο : Τεύχος Β' Κεφ.5ο : σελ.164 - 166
Ασκήσεις για επόμενο μάθημα :
----------------------------------------
Παρουσίαση μαθήματος
-----------------
Βιντεοδιάλεξη (Από Study4Exams)
Πηγή : http://chemskills.com/?q=acetic_acid_titration
Στόχοι του μαθήματος
Στο τέλος της διδακτικής αυτής ενότητας, ο μαθητής θα πρέπει να είναι ικανός :
- Να περιγράφει τη διαδικασία πραγματοποίησης μια οξεοβασικής ογκομέτρησης.
- Να εξηγεί τους όρους ισοδύναμο και τελικό σημείο και να συνδέει την απόκλιση μεταξύ τους με το σφάλμα της ογκομέτρησης.
- Να διακρίνει τα είδη της ογκομέτρησης, με βάση το είδος του προτύπου διαλύματος που χρησιμοποιείται.
- Να εξηγεί τι είναι η καμπύλη ογκομέτρησης.
- Να περιγράφει τα εξής είδη οξεοβασικής ογκομέτρησης:
-
- Ισχυρού οξέος με ισχυρή βάση και το αντίστροφο.
- Ασθενούς οξέος με ισχυρή βάση.
- Ασθενούς βάσης με ισχυρό οξύ.
- Να αξιοποιεί τα δεδομένα μιας καμπύλης ογκομέτρησης, δηλαδή της γραφικής παράστασης της σχέσης pH = f(Vπροτύπου) για να προσδιορίζει:
-
- το ισοδύναμο σημείο της ογκομέτρησης,
- αν η ογκομετρούμενη ένωση είναι οξύ ή βάση,
- αν η ογκομετρούμενη ένωση είναι ισχυρό ή ασθενές οξύ/βάση,
- ποιος δείκτης είναι ο πιο κατάλληλος για τη συγκεκριμένη ογκομέτρηση,
- την άγνωστη συγκέντρωση του διαλύματος οξέος/βάσης,
- τη σταθερά ιοντισμού του ασθενούς ηλεκτρολύτη,
- Να υπολογίζει την άγνωστη συγκέντρωση διαλύματος οξέος ή βάσης από κατάλληλα αριθμητικά δεδομένα της ογκομέτρησης.
- Να αναφέρει εφαρμογές της ογκομέτρησης από την καθημερινή ζωή.
Ύλη προς μελέτη :
Από το σχολικό βιβλίο : Τεύχος Β' Κεφ.5ο : σελ.167 - 172
Ασκήσεις :
Παράδειγμα 5.18 - Ασκήσεις : 89, 90, 121, 122
Επιπλέον υλικό :
1. Ογκομέτρηση
Παρουσίαση μαθήματος
-----------------
Σύνδεσμοι προσομοιώσεων :
Βιντεοδιάλεξη (Από Study4Exams)
Ημερολόγιο
Ανακοινώσεις
Όλες...- - Δεν υπάρχουν ανακοινώσεις -
